
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Повсеместное распространение ГПГ в мире прокариот
|
|
Вездесущесть и огромную важность горизонтального переноса генов (ГПГ) в эволюции архей и бактерий можно рассматривать как самую большую новость, выявленную с помощью сравнительного геномного анализа прокариот. Никакое другое открытие не было причиной такого большого количества споров и (порою желчных) дебатов, в которых сталкивались прямо противоположные точки зрения на ГПГ, от утверждений о его повсеместном распространении и всеобъемлющей роли в эволюции бактерий и архей до отрицания любого значимого вклада ГПГ в эволюцию (Gogarten and Townsend, 2005; Kurland et al., 2003; O’Malley and Boucher, 2005). Существование ГПГ, переноса генов между неродственными организмами иным путем, нежели посредством вертикальной передачи реплицированной хромосомы в процессе деления клетки, было осознано задолго до того, как был секвенирован первый геном (Syvanen, 1994). Более того, стало понятно, что ГПГ может происходить исключительно быстро и эффективно – во всяком случае, под давлением отбора, как в случае распространения устойчивости к антибиотикам в популяции патогенных бактерий. Однако, до того как появилась возможность сравнения множества полных геномных последовательностей, ГПГ по молчаливому соглашению рассматривался как маргинальный феномен, возможно важный для таких специфических областей, как эволюция сопротивляемости инфекциям, но по большей части не принимавшийся во внимание при изучении эволюции организмов. Как читатель, вероятно, помнит, сама важность вопроса о роли ГПГ в эволюции была осознана в связи с другим революционным открытием: демонстрацией Вёзе и соавторами того, что филогенетический анализ рРНК прокариот реально возможен и может быть потенциально использован для описания эволюции бактерий и недавно открытых архей. Для большинства биологов трехдоменное эволюционное дерево рРНК, полученное Вёзе, стало синонимом гипотетического древа жизни (ДЖ), исходно постулированного Дарвином, a теперь реально полученного и готового для использования в качестве основы для картирования эволюционных событий всевозможного рода (Pace, 2006). Такова была парадигма, когда сравнительная геномика вызвала революцию, связанную с осознанием роли ГПГ.
Исторически и методологически проблема идентификации актов ГПГ и его влияния на эволюцию бактерий и архей резко различается для случаев (сравнительно) недавних и древних переносов, с одной стороны, и переносов между близкородственными и давно разошедшимися организмами, с другой стороны (Koonin et al., 2001a). Недавние случаи ГПГ, особенно между близкородственными организмами, широко распространены, бесспорны и легко обнаруживаются. Действительно, сравнение геномов бактериальных штаммов предоставляет отчетливые свидетельства большого количества актов ГПГ. Вероятно, наиболее характерным примером является открытие так называемых островов патогенности – генных кластеров, которые несут информацию, типичную для патогенов, подобную той, что содержится в генах, кодирующих различные токсины, компоненты секреторной системы третьего типа и другие подобные системы у бактерий-паразитов, а также похожие «симбиотические острова» у бактерий-симбионтов. Острова патогенности представляют собой протяженные районы генома размером до 100 Кб, которые обычно расположены недалеко от генов тРНК и содержат множество генетического материала профагов, откуда напрашивается предположение, что вставка этих островов в геном была осуществлена при посредничестве бактериофагов (Juhas et al., 2009). Ставший классическим сравнительный геномный анализ энтерогеморрагического штамма O157:H7 и лабораторного штамма K12 бактерии E. coli показал, что патогенный штамм содержит 1,387 дополнительного гена, распределенного между несколькими специфичными для штамма кластерами (островами патогенности), сильно различающимися по размерам. Таким образом, до 30 процентов генов у патогенных штаммов, по-видимому, были приобретены посредством недавнего ГПГ (Perna et al., 2001). Последующий детальный анализ индивидуальных линий O157:H7 показал, что процесс ГПГ непрерывно продолжается, внося свой вклад в различие степени вирулентности этих штаммов (Zhang et al., 2007). Воздействие недавнего ГПГ определенно не ограничивается патогенетическими эффектами. Большинство недавних (случившихся, по оценкам, в течение последних 100 миллионов лет) добавлений в метаболическую сеть E. coli явно были вызваны ГПГ, часто включающим опероны, кодирующие два и более фермента или белка-переносчика одного и того же метаболического пути. Вклад дупликации генов в метаболические инновации оказался в количественном плане существенно менее важным.
Многочисленные исследования выявили фундаментальный вклад ГПГ в эволюцию конкретных функциональных систем прокариот. Возможно, наиболее впечатляющие результаты были получены для кластера генов фотосинтеза цианобактерий и других фотосинтезирующих бактерий (Raymond et al., 2002). Филогенетический анализ уверенно показывает, что эти кластеры представляют собой сложную мозаику генов, собранных посредством множественных актов ГПГ. Попросту говоря, кислородный фотосинтез, который сформировал нынешнюю атмосферу Земли, вероятно, появился благодаря ГПГ (Mulkidjanian et al., 2006). К тому же большинство цианофагов несут один или более ген фотосинтеза, предположительно используя их для усиления фотосинтетической активности инфицированных клеток. Таким образом, бактериофаги фактически являются переносчиками генов фотосинтеза при ГПГ (Lindell et al., 2005).
Особенно важным представляется открытие агентов переноса генов (АПГ) в нескольких группах бактерий и архей. АПГ являются дефектными производными от хвостатых бактериофагов, которые упаковывают и переносят случайные фрагменты хромосомы (не являющиеся генами профагов, кодирующими капсид и аппарат упаковки) между прокариотами (Paul, 2008). В прямых экспериментах с сообществами морских микроорганизмов было показано, что АПГ переносят гены необычайно эффективно и малоизбирательно по отношению к реципиенту (McDaniel et al., 2010). Таким образом, как это ни поразительно, АПГ вполне правомочно можно рассматривать как специализированные средства перемещения генов путем ГПГ, которые, вероятно, вносят важный вклад в потоки генов в мире прокариот. Мы вернемся к роли вирусов и АПГ в ГПГ и эволюции геномов в целом в главе 10.
Кроме непосредственной экспериментальной проверки и сравнения геномов, недавний ГПГ определяется посредством анализа состава нуклеотидов, частот олигонуклеотидных последовательностей, частоты использования тех или иных кодонов и других «лингвистических» признаков нуклеотидных последовательностей, которые обнаруживают приобретение генов в горизонтальном направлении в виде композиционных аномалий данного генома. Однако перенесенные горизонтально последовательности относительно быстро изменяются, так как приобретенные гены «одомашниваются» в процессе эволюции, так что перенесенные гены в геноме-реципиенте скоро становятся «лингвистически» неразличимы (Ragan, 2001). Важно отметить, что молекулярные механизмы ГПГ между близкородственными организмами хорошо понятны (если не сказать полностью понятны) и включают конъюгацию, перенос бактериофагами (трансдукцию) и трансформацию (Bushman, 2001).
В отличие от четко установленных недавних случаев ГПГ, особенно между компактными группами родственных организмов, обобщение явления ГПГ на большие эволюционные расстояния, особенно в отдаленном прошлом, их механизмы и влияние на эволюцию архей и бактерий остаются предметом жарких споров (Gogarten and Townsend, 2005; Kurland et al., 2003)[51]. Сравнительная геномика предоставила достаточно свидетельств вероятного ГПГ, включая перенос между очень отдаленными организмами, в частности археями и бактериями. Первым явным свидетельством массивного ГПГ между археями и бактериями было обнаружение того, что гипертермофильные бактерии (конкретно Aquifex aeolicus и Thermotoga maritima) содержат намного больше гомологов белков, характерных для архей, чем мезофильные бактерии, а также белки, имеющие гомологи как среди архей, так и среди бактерий, но с аминокислотными последовательностями, существенно больше похожими на архейные гомологи, чем на бактериальные (см. рис. 5–4)[52]. Сравнение с мезофильными бактериями показало, что доля «архейных» белков у бактерий-гипертермофилов была намного больше (причем с высокой статистической значимостью), чем у мезофилов (Aravind et al., 1998; Nelson et al., 1999). Впоследствии было продемонстрировано, что мезофильные археи с относительно большим геномом, Methanosarcina и галобактерии, обладают намного большим количеством «бактериальных» генов, чем термофильные археи с небольшими геномами (см. рис. 5–4; Deppenmeier et al., 2002). Это обстоятельство позволяет грубо оценить долю генов, которые могли быть приобретены археями и бактериями в местах их совместного обитания за счет ГПГ между ними, по крайней мере в 20 процентов.
Несмотря на эти замечательные открытия, ГПГ между эволюционно далекими прокариотами остается предметом дебатов, и все имеющиеся к настоящему времени свидетельства часто (иногда жестко) критикуются (Kurland, 2005; Kurland et al., 2003). Таксономический анализ результатов сравнения последовательностей большого числа геномов дает серьезные аргументы в пользу предполагаемого ГПГ, особенно если учесть, что для прокариот с различными стилями жизни получаются сильно разнящиеся результаты (см. рис. 5–4). И все же эти свидетельства не «доказывают» ГПГ, и в свое время были предложены иные объяснения (не всегда правдоподобные), такие как конвергенция белковых последовательностей удаленных организмов, которые живут в похожих условиях среды обитания (например, гипертермофильные археи и бактерии). Так или иначе, в течение первой декады третьего тысячелетия многочисленные филогеномные исследования – анализ филогенетических деревьев для всех (или почти всех) генов прокариот, которые являются в достаточной степени консервативными и, таким образом, содержат достаточно филогенетической информации для надежных выводов, выявили обширный перенос генов между хорошо известными группами архей и бактерий, включающий даже перенос генов между царствами (Beiko and Hamilton, 2006; Puigbo et al., 2009; Sicheritz-Ponten and Andersson, 2001). Кроме того, эти исследования продемонстрировали существование «скоростных магистралей» (highways), предпочтительных путей для потока генов (Beiko et al., 2005). Широкие магистрали связывают, в частности, различные термофильные организмы (см. также гл. 6).

Рис 5–4. Анализ генов в геномах архей и бактерий на предмет таксономической близости наиболее близких гомологов. Показаны данные для гипертермофильной бактерии Thermotoga maritima и для мезофильной археи Methanosarcina mazei. Результаты были получены программой BLASTP путем поиска аминокислотных последовательностей всех белков в каждом геноме с использованием базы данных последовательностей белков NCBI (Altschul et al., 1997).
Ключевая проблема «горизонтальной геномики» – отношение между специфичной для каждого семейства потерей генов и ГПГ. Фундаментальные исследования выявили сложный и нетривиальный характер эволюции прокариот, проявляющийся в «пятнистой» филогенетической структуре, наблюдаемой для многих КОГ (см. рис. 5–5). Такую картину можно объяснить либо ГПГ, либо потерей генов, либо комбинацией этих двух явлений. Простейший (и наиболее, как принято говорить, экономный) эволюционный сценарий можно вычислить, когда известно соотношение скоростей процессов ГПГ и потери генов. Но это отношение (которое, несомненно, различно для разных групп прокариот[53], что будет обсуждаться ниже в этой главе и в гл. 6) является одним из самых больших белых пятен в прокариотической геномике. Известно несколько глобальных реконструкций эволюции прокариот, все из которых основывались на некоторой версии принципа экономии и использовании того или иного сценария с переменным соотношением скоростей приобретения/потерь или попытками оценки оптимальной величины этого соотношения (Kunin and Ouzounis, 2003; Mirkin et al., 2003). Результатом этих исследований был вывод о том, что в процессе эволюции прокариот ГПГ может быть почти так же или несколько менее (вероятно, приблизительно вдвое) распространен, как потеря генов. Соответственно, в процессе эволюции большинства КОГ, по всей видимости, произошло по меньшей мере одно событие ГПГ, даже в пределах того ограниченного множества организмов, которые были проанализированы. Конечно, эти исследования проводились на базе сильно упрощенных предположений, таких как одинаковая для всех организмов частота ГПГ и потери генов внутри групп прокариот; представления, что высокая сложность предковых форм малоправдоподобна (казалось бы, естественная, но, по-видимому, ложная идея; см. гл. 8 об эволюции сложности); и, собственно, концепции дерева видов. Хотя результаты не сильно зависят от топологии дерева видов, базовое представление о дереве с обособленными ветвями, представляющими эволюцию сравниваемых организмов, необходимо при любой реконструкции. В этом заключается фундаментальная проблема, которая достигает буквально философских высот: для того чтобы содержательно обсуждать горизонтальный перенос, сперва непременно следует определить главное, вертикальное направление эволюции. Однако, если организмы обмениваются генами с высокой скоростью, в предельном случае совершенно свободно и равномерно, концепция вертикальной эволюции не имеет никакого смысла, так же как и противоположная ей концепция ГПГ. Следовательно, представление эволюции прокариот в виде паутины (сети) кажется логической неизбежностью (см. рис. 5–6). Я должен, однако, оговориться: хотя древовидная компонента эволюции и не обязана существовать, в эволюции прокариот она на самом деле прослеживается. Она схематически изображена на рис. 5–6 и будет главной темой в главе 6.

Рис. 5–5. Филетическая карта КОГ. Закрашенные кружки символизируют наличие члена КОГ в геноме, незакрашенные обозначают их отсутствие.
Здесь же мы продолжим обсуждение ГПГ с пониманием того, что древовидная структура действительно наблюдается как важная центральная тенденция эволюции прокариот (см. гл. 6). Широко распространено мнение, что «информационные» гены, кодирующие белки, вовлеченные в процессы трансляции, транскрипции и репликации, намного менее склонны к ГПГ, чем операционные гены, кодирующие ферменты, вовлеченные в метаболизм, транспортные системы и другие «операционные» белки. Обоснование этой точки зрения заключается в так называемой гипотезе сложности (Jain et al., 1999). В соответствии с этой гипотезой, причина низкого темпа ГПГ среди информационных генов заключается в том, что белки, кодируемые этими генами (в отличие от белков, кодируемых большинством операционных генов), обычно являются составными частями сложных белковых машин, которые сильно взаимно адаптированы и, таким образом, не могут быть легко заменены соответствующими ортологами из эволюционно далеких организмов (известными как ксенологи). Однако справедливость гипотезы сложности и ее применимость в общем случае остается неясной, так как и среди информационных генов обнаружено много очевидных случаев ГПГ. Весьма неожиданно, что эти случаи включают не только подавляющее большинство аминоцил-тРНК синтетаз (АРСаз), ферментов, функционирующих в относительной изоляции, но также многие рибосомные белки, являющиеся компонентами молекулярной машины трансляции, рибосомы (Makarova et al., 2001b). Явные свидетельства ГПГ были также обнаружены для таких традиционных маркеров вертикальной филогении, как субъединицы ДНК-зависимой РНК-полимеразы (Iyer et al., 2004a). Разница в режимах эволюции информационных и операционных генов, очевидно, обусловлена как значительно меньшим распространением замены генов неортологами, так и снижением частоты ГПГ как такового среди информационных генов.
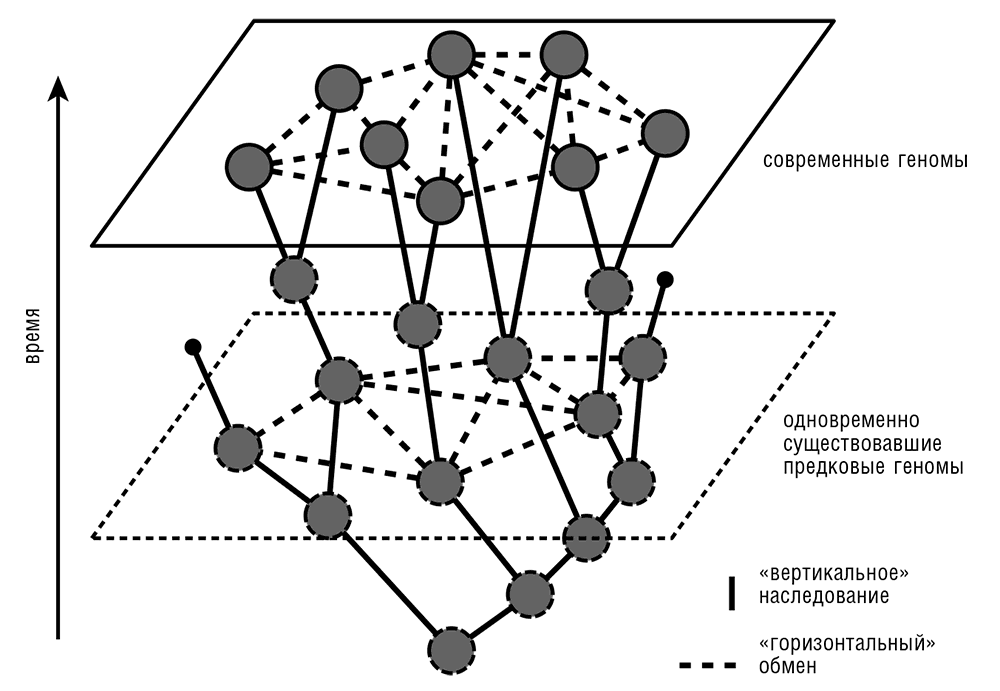
Рис. 5–6. Сетевое представление эволюции прокариот.
В свое время было высказано предположение, что ГПГ между близкородственными организмами (в соответствии с оценкой степени похожести их субъединиц рРНК и других консервативных генов) более широко распространен, чем ГПГ между эволюционно далекими организмами, и такой градиент ГПГ может вносить существенный вклад в наблюдаемую филогенетическую связь между различными группами прокариот (Gogarten et al., 2002). Систематическое изучение способности генов, полученных от других бактерий, комплементировать функции ортологов, показало, что с увеличением степени расхождения последовательностей ортологичных генов комплементация становится менее эффективной (Diaz et al.2011). Это наблюдение интуитивно привлекательно, так как перенесенный ген должен работать в другой клеточной среде, и, таким образом, можно ожидать, что чем меньше расхождение между набором генов донора и реципиента и структурой генов-ортологов, тем более вероятно, что перенесенный ген успешно приживется и будет зафиксирован отбором. Представляется вероятным, что различия в фиксации перенесенных генов в мире прокариот могут быть фактором, обеспечивающим целостность и стабильность геномов, вопреки интенсивному ГПГ. Мы вернемся к этому вопросу в главе 6 в контексте концепции древа жизни.
В завершение этого краткого обсуждения различных аспектов ГПГ в мире прокариот вернемся к гипотезе эгоистичного оперона, которая постулирует, что «организация бактериальных генов в виде оперонов выгодна для составляющих его генов, так как их близкое расположение облегчает совместный перенос всех генов, необходимых для отбираемого фенотипа» (Lawrence, 1999). Между функциональностью оперона и эгоистичным характером его эволюции нет противоречия. Оперон является «упакованной» функциональной единицей, часто включающей регулятор собственной активности. В этой роли опероны будут зафиксированы после акта ГПГ с большей вероятностью, чем одиночные гены. Тогда как первоначальная фиксация оперона происходит под влиянием преимуществ совместной регуляции функционально связанных генов, их сохранение и распространение по миру прокариот, осуществляемое при посредничестве ГПГ, происходит в эволюционном режиме, который придает оперонам некоторые (но определенно не все) свойства эгоистичных мобильных элементов. Кроме того, свойство эгоистичности оперонов можно рассматривать как способ преодоления ограничений, налагаемых гипотезой сложности, принимая во внимание, что большинство наиболее распространенных оперонов кодируют субъединицы белковых комплексов (см. предыдущую дискуссию в данной главе). Прекрасной иллюстрацией этой точки зрения является история эволюции мембранных протонных и натриевых АТФ-синтаз, в течение которой оперон, кодирующий множество (до восьми) субъединиц этих сложных молекулярных машин, неоднократно переносился между археями и бактериями (Mulkidjanian et al., 2008).
Каков, таким образом, главный вывод o распространенности и роли ГПГ в мире прокариот? С моей точки зрения, бесспорно, что ГПГ является определяющим процессом в эволюции прокариот, влияющим на все аспекты биологии бактерий и архей. Попытки отрицания ГПГ как маргинального феномена устарели и обречены на неудачу. Метафора паутины эволюции (см. рис. 5–6), по-видимому, становится неотъемлемой частью эволюционной биологии. Однако на количественном уровне вопрос o масштабах ГПГ еще далеко не решен, а также еще далеко не ясно, каковы те главные факторы, которые приводят к горизонтальному переносу индивидуальных генов и оперонов. Эти проблемы являются центральными для нашего понимания эволюции прокариот. В главе 6 мы обратимся к ним прямо.
Мобилом прокариот
Как отмечено в предыдущем разделе, вряд ли любой из членов КОГ принципиально обладает иммунитетом против ГПГ, но некоторые гены в этом отношении «более равны, чем другие». Существенная часть генетического материала прокариот состоит из эгоистичных элементов, для которых горизонтальная мобильность является основным режимом их распространения; совокупность таких элементов в свое время была метко названа мобиломом (Frost et al., 2005). Мы также обсуждаем мобилом в контексте мира вирусов (см. гл. 10), но, чтобы описать в общих чертах формирующееся логически последовательное представление об эволюции прокариот, мы должны здесь вкратце рассмотреть наиболее яркие свойства генетических элементов этого класса. Мобилом состоит из бактериофагов, плазмид, транспозонов и генов, которые часто ассоциируются с ними и регулярно становятся «пассажирами», в числе прочих, системы рестрикции-модификации (ОМ) и токсины-антитоксины (ТА). Это представляется вполне естественным, так как вирусы и плазмиды мобильны по определению, так же как и системы защиты. Мобилом неразрывно связан с «главными» хромосомами прокариот. Вирусы (бактериофаги) и многие плазмиды систематически интегрируются в хромосомы, либо обратимо, в этом случае они часто мобилизируют хромосомные гены, либо необратимо, когда мобильные элементы «одомашниваются», превращаясь в «обычные» гены, изначально ОРС (см. выше раздел «Фрактальное пространство-время генома, пангеномы и кластеризация прокариот»). Со времен классического эксперимента Жакоба и Волмана в 1950-х было хорошо известно, что конъюгативные плазмиды могут быть посредниками при перемещении больших фрагментов бактериальных хромосом, a вирусы (бактериофаги) давно известны как посредники при переносе генов путем трансдукции (Bushman, 2001). Открытие АПГ, которые, по-видимому, являются специализированными векторами для ГПГ, еще более убедительно подтверждает существование механизмов, регулирующих обмен генетическим материалом между мобиломом и хромосомами (Paul, 2008).
Перенос плазмидами устойчивости к антибиотикам и путей вторичного метаболизма является хрестоматийным примером динамики бактериальной мобиломы, но роль плазмид далеко не исчерпывается такими относительно узкими областями биологии. На самом деле граница между хромосомами и плазмидами весьма размыта. Плазмиды являются репликонами (обычно циркулярными, но иногда и линейными), которые, подобно хромосомам прокариот, имеют точку начала репликации и кодируют по крайней мере некоторые из белков, участвующих в собственной репликации и сегрегации (распределении реплицированных плазмид между дочерними клетками в процессе деления). Ключевые белки, вовлеченные в процессы сегрегации плазмид и хромосом, в частности АТФазы семейств FtsK/HerA, гомологичны во всем мире прокариот (а также обнаружены у многих вирусов – см. гл. 10), факт, который подчеркивает общность эволюционного происхождения и стратегий различных прокариотических репликонов (Iyer et al., 2004b; McGeoch and Bell, 2008).
«Канонические» геномы многих бактерий и архей включают, в дополнение к «главной» хромосоме (или хромосомам), один или больше неотъемлемых, относительно больших и стабильных внехромосомных элемента, часто называемых мегаплазмидами. Мегаплазмиды могут удивительно долго сохраняться в процессе эволюции. Например, единственная мегаплазмида бактерии Thermus thermophilis гомологична одному или двум мегаплазмидам бактерии Deinococcus radiodurans и, следовательно, произошла от общего предка этих родственных, но сильно разошедшихся бактерий (Omelchenko et al., 2005). Однако в процессе эволюции этой древней группы бактерий мегаплазмиды накопили (относительно своих размеров) намного больше отличий в составе генов, чем хромосомы. Кроме того, мегаплазмиды имеют много горизонтально перенесенных генов, включая гены термофильных организмов, которые, очевидно, были приобретены линией Thermus и важны для их термофильного стиля жизни. Таким образом, хотя мегаплазмиды могут существовать в геномах прокариот в течение продолжительного по эволюционным меркам времени, они демонстрируют большую эволюционную пластичность, чем хромосомы, и служат своеобразными «запасниками» для ГПГ.
Почти все секвенированные геномы прокариот содержат следы интеграции многочисленных плазмид и фагов. В частности, примечательно, что большинство геномов архей обладают несколькими версиями оперона herA-nurA, который кодирует ключевые компоненты (АТФазы и нуклеазы) механизма сегрегации плазмид после репликации. Каждый из этих оперонов является остатком отдельного репликона, таким образом, слияние репликонов, по-видимому, является у прокариот достаточно частым событием. В ходе эволюции такая интеграция могла быть важным фактором, который сформировал наблюдаемую архитектуру хромосом прокариот (Iyer et al., 2004b; McGeoch and Bell, 2008).
Системы защиты и ответа на стресс, в частности, рестрикции-модификации и системы токсин-антитоксин можно рассматривать в качестве особых частей мобилома. Сравнительный анализ этих систем выявил быструю эволюцию и частый ГПГ; кроме того, они часто обнаруживаются в геномах плазмид и бактериофагов. Несмотря на их громадное молекулярное разнообразие, эти системы работают на одном и том же принципе – каждая содержит токсин, то есть белок, который либо разрушает хромосомную ДНК (ферменты рестрикции), либо блокирует систему трансляции в результате гидролиза мРНК или тРНК (соотвествующие токсины обладают эндонуклеазной активностью, специфичной к РНК), либо убивает клетку, вызывая образование отверстий в мембране (Kobayashi, 2001; Van Melderen and Saavedra De Bast, 2009). Вызванная токсинами гибель клетки в случае использования систем рестрикции-модификации предотвращается специфическим метилированием ДНК, a в случае систем токсин-антитоксин путем нейтрализации токсина антитоксином. Эта нейтрализация достигается либо посредством взаимодействия двух белков (токсина и антитоксина), либо посредством подавления трансляции мРНК токсина комплементарной к ней малой РНК, которая в этом случае выполняет роль антитоксина. Эти системы обладают свойствами эгоистичных элементов, которые эволюционировали таким образом, чтобы сделать клетки хозяина зависимыми от них (addicted). Когда клетка теряет соответствующие гены, она обычно погибает либо в результате действия токсина, поскольку токсины более стабильны, чем антитоксины, так что их активность после деградации антитоксинов, запасы которых перестают восполняться, резко возрастает, либо из-за ослабления активности ферментов модификации в результате снижения их концентрации, в то время как рестриктазы сохраняют активность. Из-за этого свойства токсин-антитоксинных систем плазмиды, которые переносят токсин-антитоксинные гены и, таким образом, гарантируют, что их хозяева «подсядут» на них, убивая клетки, которые утратили плазмиды, получают сильное селективное преимущество перед плазмидами, не имеющими токсин-антитоксинных систем. Известные к настоящему времени токсин-антитоксинные системы, вероятно, представляют, как принято говорить, лишь вершину айсберга, так как геномы бактерий и архей несут большое количество различных оперонов, имеющих свойства, сближающие их с токсин-антитоксинными оперонами (а именно пара генов, кодирующих небольшие белки, которая появляется в одинаковой комбинации в различных геномах и геномных окружениях), но которые не были (пока) экспериментально исследованы (Makarova et al., 2009a).
Недавно был открыт еще один очень необычный класс систем мобильной защиты, который присутствует у большинства архей и примерно одной трети бактерий из числа секвенированных геномов (Deveau et al., 2010; Koonin and Makarova, 2009). Эта система состоит из массива коротких палиндромных повторов, регулярно расположенных группами (CRISPR), и включает в себя около 50 отдельных семейств генов (ассоциированных с CRISPR и обозначаемых cas (CRISPR-associated). Примечательно, что здесь мы сталкиваемся со вторым по размерам (после рибосомного супероперона) массивом связанных между собой генов (генетическим окружением) в геномах прокариот (Rogozin et al., 2002). Система CRISPR-Cas защищает клетки прокариот от фагов и плазмид «ламарковским путем» (мы вернемся к этому вопросу более подробно в гл. 9): фрагмент гена фага или плазмида интегрируется в локус CRISPR на бактериальной хромосоме и впоследствии транскрибируется и используется посредством все еще плохо изученных механизмов для подавления репликации эгоистичных агентов. Система CRISPR-Cas демонстрирует выдающуюся пластичность даже между близкородственными штаммами бактерий и архей, а также, по-видимому, часто переносится путем ГПГ.
Избранные примеры, обсуждавшиеся выше, указывают на огромное, все еще не до конца понятое разнообразие мобилома прокариот и подчеркивают значительный вклад, который мобилом вносит в эволюцию геномного пространства-времени прокариот.
Date: 2016-05-15; view: 656; Нарушение авторских прав