
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Теоретичні відомості. Поверхневий натяг (s) – це робота, яку необхідно витратити для утворення 1м2 нової поверхні розділу фаз
|
|
Поверхневий натяг (s) – це робота, яку необхідно витратити для утворення 1м2 нової поверхні розділу фаз, або еквівалентна їй вільна енергія, що припадає на 1м2 поверхні. Сила поверхневого натягу спрямована тангенціально до поверхні рідини і вимірюється в Н/м або в Дж/м2.
Поверхня розділу фаз характеризується надлишком питомої вільної поверхневої енергії. Мимовільні процеси протікають зі зменшенням вільної енергії системи. Тому рідина завжди намагається зберегти мінімальну поверхню, що відповідає мінімуму вільної поверхневої енергії. Цим пояснюється сферична форма крапель рідини.
Чисті індивідуальні рідини мають певні значення s. Серед рідин найбільший поверхневий натяг має вода – 72,75 мДж/м2 при 293 К. З підвищенням температури поверхневий натяг рідин зменшується.
Безпосередньо визначати поверхневий натяг можна тільки в рідинах, оскільки в них краплі зливаються, утворюючи нову поверхню. Відома велика кількість методів визначення поверхневого натягу, які можна поділити на три групи: статичні, напівстатичні та динамічні.
Сталагмометричний метод (напівстатичний) базується на визначенні поверхневого натягу рідини шляхом підрахунку кількості крапель n рідини. Ґрунтується на залежності кількості крапель n, утворених з рідини, що міститься в об'ємі сталагмометра Vст, від поверхневого натягу рідини.
Крапля відривається від кінця капіляра сталагмометра, якщо її маса Рк буде перевищувати силу поверхневого натягу по периметру капіляра f
Рк=Vк∙ d (7.1)
де Vк – об’єм однієї краплі; d – густина рідини.
f=2∙π∙r∙σ, (7.2)
де r – радіус капіляра сталагмометра.
Якщо з об’єму сталагмометра Vст, обмеженого двома позначками, утворюється n крапель, то об’єм однієї краплі:
 (7.3)
(7.3)
Тоді математичною умовою відриву краплі від кінця капіляра сталагмометра буде таке рівняння:
2∙π∙r∙σ =  (7.4)
(7.4)
Для виключення з одержаного рівняння параметрів сталагмометра (його об’єм Vст та радіус капіляра r) підрахунок числа крапель n починають з еталонної рідини – дистильованої води, для якої відомий поверхневий натяг –  . Умові відриву крапель дистильованої води буде відповідати таке рівняння:
. Умові відриву крапель дистильованої води буде відповідати таке рівняння:
2∙π∙r∙  =
=  (7.5)
(7.5)
Потім сталагмометр наповнюють досліджуваною рідиною розчину. Його поверхневий натяг невідомий σ1 і може бути розрахований згідно з рівнянням:
2∙π∙r ∙  =
=  . (7.6)
. (7.6)
Для виключення з розрахунку параметрів сталагмометра, треба ліву та праву частини рівняння (7.5) розділити на відповідні частини рівняння (7.6). Отримуємо:
 . (7.7)
. (7.7)
Оскільки в роботі вимірювання проводять тільки з розбавленими розчинами, можна вважати, що густина розчину d1 мало відрізняється від густини води  .
.
Отже, рівняння можна спростити:
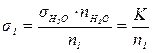 (7.8)
(7.8)
Добуток  визначається як константа сталагмометра. Значення
визначається як константа сталагмометра. Значення 
 залежить від температури. Для розрахунку константи сталагмометра беруть табличне значення поверхневого натягу води
залежить від температури. Для розрахунку константи сталагмометра беруть табличне значення поверхневого натягу води  (Дж/м2) згідно з температурою досліду в лабораторії:
(Дж/м2) згідно з температурою досліду в лабораторії:
 = 0,07305;
= 0,07305;  = 0,07290;
= 0,07290;  = 0,07275;
= 0,07275; 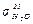 = 0,07259;
= 0,07259;
 = 0,07244;
= 0,07244;  = 0,07228;
= 0,07228;  = 0,07213;
= 0,07213;  = 0,07197
= 0,07197
Адсорбція – це процес накопичення розчиненої речовини (або газу) на межі розділу фаз, який характеризується зміною концентрації компонента в поверхневому шарі порівняно з об’ємною фазою. Адсорбцію виражають в моль/м2. Адсорбція відноситься до поверхневих явищ і протікає мимовільно, оскільки супроводжується зменшенням вільної поверхневої енергії F, тобто це термодинамічно вигідний процес.
Речовини, додавання яких до розчину веде до різкого зменшення поверхневого натягу і вільної поверхневої енергії на межі поділу фаз, називаються поверхнево-активними речовинами (ПАР).
Рівняння ізотерми адсорбції Гіббса встановлює залежність між гіббсівською адсорбцією Г, концентрацією поверхнево-активної речовини С і зміною поверхневого натягу за концентрацією  .
.
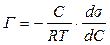 (7.9)
(7.9)
Графічна залежність поверхневого натягу рідини від концентрації розчиненої речовини називається ізотермою поверхневого натягу, яка графічно зображується в координатах s=f(С). Залежність адсорбції від концентрації розчиненої речовини Г=f(С) при сталій температурі називається ізотермою адсорбції.
Здатність речовини знижувати поверхневий натяг при адсорбції на межі розділу фаз називається поверхневою активністю. Ця величина графічно визначається як тангенс кута нахилу дотичної до ізотерми поверхневого натягу в початковій точці (С=0), що відповідає поверхневому натягу чистого розчинника. Чим більше значення поверхневої активності, тим вища здатність адсорбтива зменшувати поверхневий натяг на межі розділу фаз і тим крутіша ізотерма поверхневого натягу.
Прикладами ПАР є жирні кислоти та їх солі, спирти тощо. Речовини, при додаванні яких підвищується поверхневий натяг, називаються поверхнево-інактивними речовинами (ПІР). До ПІР відносяться електроліти (неорганічні кислоти, основи, солі).
Поверхнева активність молекул ПАР сильно залежить від довжини вуглеводневого радикала. За правилом Дюкло-Траубе у розведених водних розчинах здатність ПАР знижувати поверхневий натяг з переходом до кожного наступного члена гомологічного ряду збільшується приблизно в 3,2 рази, тобто поверхнева активність у гомологічному ряду збільшується в 3,2 рази при зростанні довжини неполярного радикалу на одну -СН2 групу.
 Рис. 7.1. Схема будови молекули ПАР
Рис. 7.1. Схема будови молекули ПАР
| Молекули ПАР мають дифільну структуру. Така молекула складається з полярної групи і неполярного вуглеводневого радикала. Полярна група має великий дипольний момент і добре гідратована в розчині, тобто має спорідненість до води. Друга частина молекули ПАР – це радикал, він неполярний гідрофобний, немає спорідненості до води і виштовхується з неї. Вуглеводневий радикал обумовлює низьку розчинність ПАР у воді. |
Гідрофільними групами в молекулах ПАР можуть бути –СООН, –ОН, –СНО, – NH2, – NO2, –SH, –CN, –Cl та інші.
 На межі поділу фаз рідина – газ (повітря) молекула ПАР орієнтується таким чином, що гідрофільна частина молекули, що має спорідненість до води, взаємодіє з водою, а неполярна гідрофобна частина виштовхується в неполярну фазу (повітря).
На межі поділу фаз рідина – газ (повітря) молекула ПАР орієнтується таким чином, що гідрофільна частина молекули, що має спорідненість до води, взаємодіє з водою, а неполярна гідрофобна частина виштовхується в неполярну фазу (повітря).
При підвищенні концентрації речовини в розчині (С) адсорбція збільшується спочатку різко, а потім все повільніше, асимптотично наближаючись до певної межі. Адсорбція збільшується зі збільшенням довжини ланцюга в гомологічному ряду, але для всіх членів ряду криві наближаються до одного і того ж граничного значення  , що відповідає насиченому мономолекулярному адсорбційному шару (рис. 7.2, в)
, що відповідає насиченому мономолекулярному адсорбційному шару (рис. 7.2, в)

Рис. 7.2 Будова адсорбційного шару на межі розділу рідина – газ
Гранична адсорбція ( )– це кількість молів даної речовини, яку необхідно розмістити на одиниці поверхні, щоб утворився шар адсорбованої речовини товщиною в одну молекулу (мономолекулярний шар).
)– це кількість молів даної речовини, яку необхідно розмістити на одиниці поверхні, щоб утворився шар адсорбованої речовини товщиною в одну молекулу (мономолекулярний шар).
Визначивши граничну адсорбцію, можна розрахувати розміри молекул ПАР. Площу поперечного перерізу або площу, яку займає одна молекула в насиченому адсорбційному моношарі, q, визначають як:
 , (7.10)
, (7.10)
де NA – число Авогадро.
Цю величину ще називають “посадковою площею" молекули. Ця величина залежить від природи полярної групи і є однаковою для членів одного гомологічного ряду ПАР.
Товщина насиченого мономолекулярного адсорбційного шару дорівнює довжині δ неполярного радикала молекули ПАР. Маса 1м2 адсорбційного шару P=Vr, де V – об’єм адсорбційного шару, а r – густина речовини в конденсованому адсорбційному шарі, що практично дорівнює густині речовини в звичайних умовах. Об’єм 1м2 моношару дорівнює добутку його площі та висоти, тобто: V=1 δ м3. Отже, об’єм 1м2 моношару буде визначатися величиною висоти або довжини молекули δ, а маса 1м2 моношару P=V∙r=δ r. Одночасно маса 1м2 моношару може бути визначена через місткість моношару: Р=  ∙М, де М – молекулярна маса речовини. Отже, враховуючи, що Р=
∙М, де М – молекулярна маса речовини. Отже, враховуючи, що Р=  ∙М= δ r, визначаємо довжину молекули ПАР, яка дорівнює товщині насиченого мономолекулярного адсорбційного шару:
∙М= δ r, визначаємо довжину молекули ПАР, яка дорівнює товщині насиченого мономолекулярного адсорбційного шару:
 , (7.11)
, (7.11)
де  – густина розчину; М – її молекулярна маса.
– густина розчину; М – її молекулярна маса.
У гомологічному ряду жирних кислот площа, яку займають молекули різних кислот, виявилась майже однаковою для всіх кислот: q=20,5×10-20 м2.
Величину граничної (максимальної) адсорбції можна розрахувати з рівняння Ленгмюра:
 , (7.12)
, (7.12)
де Г – гіббсівська адсорбція;  – гранична адсорбція; С – концентрація ПАР; A – константа.
– гранична адсорбція; С – концентрація ПАР; A – константа.
Рівняння Ленгмюра дає можливість визначити граничну адсорбцію  .
.
Рис. 7.3. Графічне визначення 
| Для цього необхідно експериментально встановити залежність адсорбції від концентрації  . Тоді рівняння Ленгмюра (7.12) записують у вигляді: . Тоді рівняння Ленгмюра (7.12) записують у вигляді:
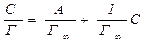 (7.13)
Будують графічну залежність в лінійних координатах (7.13)
Будують графічну залежність в лінійних координатах 
|
(рис. 7.3.) і визначають Г  як котангенс кута нахилу aпобудованої прямої до вісі абсцис (
як котангенс кута нахилу aпобудованої прямої до вісі абсцис ( ).
).
Завдання на виконання роботи
1. Визначити поверхневий натяг дистильованої води та водних розчинів з різною концентрацією ПАР, використовуючи сталагмометричний метод.
2. Провести дослідження залежності поверхневого натягу розчинів від концентрації ПАР, побудувати ізотерму поверхневого натягу в координатах (σ, Дж/м2 ) =f (C, моль/л).
3. Розрахувати та побудувати за ізотермою поверхневого натягу ізотерму адсорбції Гіббса в координатах (Г, моль/м2 ) = f(C, моль/л).
4. За методом графічного розв'язування рівняння Ленгмюра розрахувати значення граничної адсорбції Г 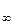 , моль/м2 ПАР у моношарі на межі поділу розчин – повітря.
, моль/м2 ПАР у моношарі на межі поділу розчин – повітря.
5. Розрахувати параметри молекул ПАР – довжину та "посадкову площу" однієї молекули ПАР у насиченому моношарі.
Прилади, лабораторний посуд та реактиви
Сталагмометр, шість конічних колб ємністю 50 мл, розчини органічних кислот та спиртів.
Порядок виконання лабораторної роботи
1. Сталу сталагмометра визначають за дистильованою водою, використовуючи рівняння  .
.
2. Готують п’ять робочих розчинів послідовним розведенням удвічі 20 мл розчину ПАР з відомою вихідною концентрацією (табл. 7.1).
3. Вимірюють поверхневий натяг розчинів, починаючи з найбільш розведеного розчину і закінчуючи початковим (нерозведеним). Експериментальні дані за кількістю краплин рідини, що витікає з сталагмометра від позначки до позначки, записують у робочу табл. 7.2 у порядку збільшення концентрації ПАР у розчині, починаючи з даних для дистильованої води, поверхневий натяг якої повинен відповідати температурі досліду в лабораторії.
4. За даними робочої табл. 7.2 будують ізотерму поверхневого натягу (рис. 7.4)
Таблиця 7.1
Date: 2016-01-20; view: 658; Нарушение авторских прав
