
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Теоретичні відомості. Електрохімія вивчає закономірності перетворення енергії хімічних реакцій в електричну при збереженні загального енергетичного балансу
|
|
Електрохімія вивчає закономірності перетворення енергії хімічних реакцій в електричну при збереженні загального енергетичного балансу. Таке перетворення практично реалізується для електрохімічних систем в формі роботи гальванічних елементів, у яких проходять окисно-відновні реакції.
На межі поділу любих двох фаз тверда–тверда, (наприклад Zn/Сu, Cd/Ag), тверда–рідка, (наприклад Zn/розчин ZnSO4, Cu/розчин CuSO4),рідка–рідка (розчин ZnSO4, розчин CuSO4), кожна з яких окремо є електронейтральною, виникає стрибок електричного потенціалу.
Розглянемо систему, яку в електрохімії називають "метал в розчині своїх іонів" (прикладом є мідна пластинка занурена в розчин сульфату міді). Через деякий час на межі Cu/розчин CuSO4 встановлюється рівновага, обумовлена рівністю хімічних потенціалів речовини в обох фазах і їй відповідає рівноважний стрибок потенціалу.
В розглянутому випадку іони міді в металі містяться у вузлах металевої ґратки, а в водному розчині вони гідратовані. Щоб вилучити іони міді з розчину, необхідно подолати енергію гідратації Uг, тобто енергію зв’язку його з молекулами води, а для видалення іону з металевої ґратки, необхідно подолати енергію Uв, що дорівнює роботі виходу іона з металу. При зануренні металевої пластинки в розчин своїх іонів напрям переходу іонів визначається співвідношенням Uг і Uв, тобто, якщо Uв ³ Uг (як для міді) – іони металу будуть переходити із розчину на межу поділу метал–розчин. Оскільки іони міді несуть позитивні заряди, пластинка набуде позитивного заряду, а розчин – негативного. Відповідні заряди в обох середовищах (позитивні в металі і негативні в розчині) розташовуються поблизу поверхні, утворюючи на поверхні метал – розчин подвійний електричний шар (ПЕШ). При співвідношенні Uв £ Uг, метал зарядиться негативно, а розчин – позитивно (рис. 5.1). В цьому випадку подвійний електричний шар утворюється надлишковими електронами на металі та іонами металу в розчині.
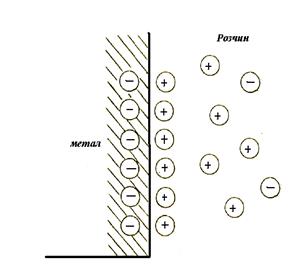 Рис. 5.1. Схема утворення подвійного електричного шару (ПЕШ)
Рис. 5.1. Схема утворення подвійного електричного шару (ПЕШ)
| Різниця потенціалів j, що виникає між металом і розчином, називається міжфазовим потенціалом. Прямих методів вимірювання абсолютних значень міжфазових потенціалів поки що немає, можна виміряти лише різницю потенціалів між точками, що знаходяться в межах однієї фази. Гальванічний елемент – це пристрій для перетворення хімічної енергії будь-якої окиснювально-відновної реакції в електричну енергію. |
Розглянемо гальванічний елемент Якобі - Даніеля, схема якого наведена на рис. 5.2.
 Рис. 5.2. Схема гальванічного елемента Даніеля-Якобі: 1 – цинковий напівелемент;
2 – цинковий електрод; 3 – розчин ZnSO4;
4, 5 – скляні трубки з зовнішніми проводами; 6 – розчин CuSO4; 7 – мідний напівелемент; 8 – мідний електрод; 9 – склянка з насиченим розчином KCl ( соляний місток)
Рис. 5.2. Схема гальванічного елемента Даніеля-Якобі: 1 – цинковий напівелемент;
2 – цинковий електрод; 3 – розчин ZnSO4;
4, 5 – скляні трубки з зовнішніми проводами; 6 – розчин CuSO4; 7 – мідний напівелемент; 8 – мідний електрод; 9 – склянка з насиченим розчином KCl ( соляний місток)
| Контакт між електродами здійснюється за допомогою з'єднуючого провідника (будь-якого провідника першого роду), а контакт між електролітами – за допомогою пористої перетинки, що перешкоджає механічному змішуванню розчинів і не перешкоджає переносу струму іонами, або за допомогою проміжного агар-агарового містка, виготовленого на розчині хлористого калію. Цей кордон розділяє гальванічний елемент на два напівелементи. |
На одному з них (катоді) йде відновлювальний процес, який супроводжується асиміляцією електронів, наприклад Сu2++2е=Сu, на другому (аноді) – окислювальний, наприклад Zn–2e=Zn2+, що є джерелом електронів.
Часто гальванічні елементи записують схематично, при цьому показують послідовність контактів реагуючих речовин, які перебувають в різних фазах, розділяючи їх вертикальними лініями. Наприклад, запис елемента Даніеля-Якобі
(–)Cu/Zn/ZnSO4//CuSO4/Cu(+)
Спостерігаємо три міжфазових стрибки електричного потенціалу:
 ,
, 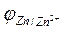 ,
, 
які свідчать, що елемент Якобі-Даніеля є нерівноважною електрохімічною системою, в якій виникає різниця потенціалів Е, що дорівнює сумі міжфазових стрибків потенціалів:
 (5.1)
(5.1)
де Е – електрорушійна сила (ЕРС) гальванічного елемента.
Оскільки чисельні значення міжфазових потенціалів не піддаються експериментальному визначенню, в електрохімічній практиці для розрахунків ЕРС гальванічних елементів широко використовують рівняння, що зв’язує ЕРС з електродними потенціалами e.
Тоді ЕРС дорівнює максимальній різниці електродних потенціалів:
 (5.2)
(5.2)
За визначенням електродний потенціал будь-якого напівелемента – це ЕРС ланцюга, який складено з напівелемента, що досліджується і напівелемента порівняння, електродний потенціал якого постійний. Таким електродом порівняння в електрохімії може бути нормальний водневий електрод (НВЕ), потенціал якого прийнятий рівним нулю.
В гальванічному елементі Якобі-Даніеля відбувається окиснення цинку і перехід в розчин його іонів:
Ζn – 2е«Ζn2+
і відновлення іонів міді та осадження їх на електроді:
Сu2++2е«Сu
Цинковий електрод в даному елементі буде мати від’ємний заряд, а мідний – додатній. Електрони переходять по замкнутому металевому провіднику від цинкового електроду до мідного.
Сумарна реакція в елементі становить:
Ζn+ Сu2+«Ζn2++ Сu
Якщо процес, в гальванічному елементі провести в зворотних умовах (електроліз), за Р=const і T=const, то велементі виконується максимальна корисна робота, що дорівнює зменшенню ізобарного потенціалу системи:
А’max= –DGT = z·F·E (5.3)
де z – число електронів, що беруть участь в реакції; F – стала Фарадея, 96493Кл / моль; E – ЕРС гальванічного елемента.
Для цієї реакції запишемо рівняння ізотерми:
 (5.4)
(5.4)
де активності нейтральних атомів цинку та міді дорівнюють: aZn=аCu= 1.
Виходячи із рівняння (5.3)
 (5.5)
(5.5)
звідки,
 (5.6)
(5.6)
Якщо активності всіх речовин реакції дорівнюють одиниці, то ЕРС (Е) приймає значення стандартної ЕРС (Е о)
 (5.7)
(5.7)
де Е о– стандартна ЕРС.
Таким чином, рівняння (5.6) можна записати в загальному вигляді:
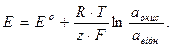 (5.8)
(5.8)
По аналогії для електродного потенціалу одержимо:
 (5.9)
(5.9)
де  – нормальний електродний потенціал, що дорівнює потенціалу рівноважного оберненого електрода, зануреного в розчин, в якому активність потенціалвизначальних іонів а, дорівнює одиниці. Співвідношення (5.8) і (5.9) мають назву рівняння Нернста–Тюріна.
– нормальний електродний потенціал, що дорівнює потенціалу рівноважного оберненого електрода, зануреного в розчин, в якому активність потенціалвизначальних іонів а, дорівнює одиниці. Співвідношення (5.8) і (5.9) мають назву рівняння Нернста–Тюріна.
Стандартну ЕРС можна визначити як різницю електродних потенціалів:
 (5.10)
(5.10)
Нормальні електродні потенціали різних металів виміряні відносно нормального водневого електрода і зведені в таблицю. Якщо розмістити метали в порядку зростання їх нормальних (стандартних) електродних потенціалів, отримаємо так званий ряд напруги.
Всі метали, розміщені в ряду напруг до водню, мають негативний нормальний електродний потенціал, тобто на таких електродах при роботі відповідного гальванічного елемента відбувається процес окиснення металу. Позитивний нормальний електродний потенціал, який мають метали, що стоять за воднем, означає, що відносно нормального водневого електроду даний електрод заряджується позитивно, тобто при роботі елемента відбувається процес відновлення металу.
Електроди першого роду – це металеві або газові електроди, занурені в розчин своїх іонів і обернені відносно цих іонів (аніонів і катіонів), від активності яких залежить потенціал електроду. Прикладом електродів першого роду можуть бути мідний Cu/Сu2+, цинковий Zn/Zn2+, водневий Pt(H2)H+,хлорний Pt(Cl2)Cl– тощо.
 Рис. 5.3. Нормальний водневий електрод: 1 – посудина; 2 – платиновий електрод; 3 – скляна трубка; 4, 8 – крани; 5 – трубка введення водню; 6 – гідрозатвор; 7 – сифон
Рис. 5.3. Нормальний водневий електрод: 1 – посудина; 2 – платиновий електрод; 3 – скляна трубка; 4, 8 – крани; 5 – трубка введення водню; 6 – гідрозатвор; 7 – сифон
| Нормальний водневий електрод (рис. 5.3) складається із платини, покритої платиновою чернотою і частково зануреної в розчин, в якому активність іонів водню дорівнює одиниці, а тиск водню в газовій фазі – 101325 Па. Потенціал такого електрода при t=25 °С умовно прийнято за нуль.
Електродна реакція, що проходить на платині:
1/2Н2«Н++е
Потенціал водневого електрода в загальному випадку визначається рівнянням:
 (5.11)
де (5.11)
де  – нормальний потенціал, прийнятий рівним нулю; – нормальний потенціал, прийнятий рівним нулю;
 –рівноважний тиск водню над платиною. –рівноважний тиск водню над платиною.
|
Оскільки вимірювання з водневим електродом проводять приблизно при тиску 1 атм
 (5.12)
(5.12)
Незручності при користуванні водневим електродом обумовлені необхідністю мати очищений водень, який безперервно пропускають через розчин. Потенціал водневого електрода нестійкий і встановлюється повільно, тому на практиці у якості електрода порівняння використовують, як правило, електроди другого роду.
Електроди другого роду – це метали, вкриті шаром малорозчинної солі металу і занурені в розчин добре розчинної солі, яка має спільний аніон з малорозчинною сіллю. Ці електроди можна розглядати як зворотні відносно аніону, тому їх потенціал можна розрахувати через активність аніонів. Прикладом електродів другого роду є каломельний, хлоросрібний тощо.
 Рис. 5.4. Каломельний електрод: 1 – ртуть: 2 – платиновий дріт; 3 – каломель; 4 – сифон; 5 – розчин KCl
Рис. 5.4. Каломельний електрод: 1 – ртуть: 2 – платиновий дріт; 3 – каломель; 4 – сифон; 5 – розчин KCl
| Каломельний електрод (рис. 5.4) складається з ртуті, пасти, виготовленої з каломелі, платинового дроту, мідного дроту-виводу, пробки і сифону. Електрод заливають розчином КСl, залежно від концентрації якого розрізняють 0,1 н, нормальний (1,0 н КСl)інасичений каломельні електроди.
В каломельному електроді проходить реакція
Hg – e «Hg+.
Електродний потенціал дорівнює:
 (5.13) (5.13)
|
Окисно-відновні електроди ( Red-Oxy) – це електроди, матеріал яких не бере участі в електродній реакції, а тільки в передачі електронів від окисника до відновника, що перебувають в одному розчині. Прикладом такого електрода може бути платина, занурена в розчин, що містить Fe2+і Fe3+або Sn2+і Sn4+. Відмінність окисно-відновних електродів від інших полягає в тому, що продукти окиснення або відновлення залишаються в розчині, а не виділяються на електродах.
Електродний потенціал такого електрода, наприклад Pt/Sn4+ / Sn2+
 (5.14)
(5.14)
Серед Red-Oxy-електродів широко застосовується хінгідронний електрод, що використовується для визначення концентрації водневих іонів в розчині. Це платиновий електрод, занурений в розчин хінгідрону (С6Н4)2O2(OН)2, що розпадається у водному розчині на еквівалентні кількості хінону С6Н4O2і гідрохінону С6Н4(OН)2. Останній є двохосновною кислотою, дисоціює з утворенням аніона С6Н4O2–, який при окисненні переходить в хінон. Сумарно реакцію можна виразити рівнянням:
С6Н4(OН)2 «С6Н4O2+2Н++2е
Потенціал хінгідронного електрода:
 (5.15)
(5.15)
тобто потенціал хінгідронного електрода визначається концентрацією іонів водню або рН розчину ( ).
).
Вимірювання електродних потенціалів окремих електродів (напівелементів) проводиться лише у формі гальванічних елементів, складених із напівелемента, електродний потенціал якого підлягає визначенню і стандартного електрода порівняння каломельного, електродний потенціал якого відносно нормального водневого електрода відомий. e о кал=+0,2483 В.
Наприклад, для визначення потенціалів мідного і цинкового електродів в елементі Якобі-Даніеля за допомогою каломельного електрода порівняння складають два ланцюги:
(–) Hg/Hg2Cl2/KClнас//CuSO4/Cu(+)
(–) Zn/ZnSO4//KClнас/Hg2Cl2/Hg(+)
і визначають їх ЕРС.
У першому колі каломельний електрод грає роль негативного електрода, в другому – позитивного. Знаки електродів визначають, користуючись таблицею стандартних електродних потенціалів і порівнюють їх з потенціалом електрода порівняння. Увказаних елементах проходять такі електрохімічні реакції:
2Cl–+2Hg–2е→ Hg2Cl2 ; Cu2++2е→ Cu
Zn–2е→Zn2+; Hg2Cl2+2е→2Hg+2Cl–
Значення потенціалів визначають на підставі таких міркувань, знаючи ЕРС гальванічного елемента:
ЕCu-кал=eСu – eкал, (5.16)
потенціал катоду дорівнює:
eСu=ЕCu-кал + eкал (5.17)
Маючи виміряну ЕРС гальванічного елемента:
ЕZn-кал=eкал – eZn, (5.18)
потенціал аноду дорівнює:
eZn=eкал – ЕZn-кал . (5.19)
Отримані значення електродних потенціалів порівнюють з розрахованими за рівнянням Нернста-Тюріна.
Date: 2016-01-20; view: 614; Нарушение авторских прав