
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Теоретичні відомості. За електричною провідністю розрізняють провідники першого і другого роду
|
|
За електричною провідністю розрізняють провідники першого і другого роду. До перших належать всі метали та їх сплави, а до других – розчини і розплави електролітів. В розчинах електролітів електричний струм проводиться за допомогою іонів, які переміщуються до відповідних електродів.
Згідно з теорією Арреніуса, молекули електролітів у водних розчинах дисоціюють на іони, які і переносять електричний струм. Одні електроліти дисоціюють в розчинах повністю (сильні), інші частково (слабкі). Електрична провідність слабких електролітів визначається в основному ступенем дисоціації, яка залежить від концентрації електроліту і температури.
Властивість систем проводити електричний струм визначається опором або електричною провідністю. Опір R провідника пропорційний його довжині l (м) і обернено пропорційний площині поперечного перерізу S (м2).
 (4.1)
(4.1)
Коефіцієнт пропорційності r (Ом×м), який дорівнює опору провідника при l = 1 м і S=1м2 називається питомим опором.
Електрична провідність – величина, обернена опору, Ом-1:
 (4.2)
(4.2)
а питомa електричнa провідність c – величина, обернена питомому опору, См/м:


 (4.3)
(4.3)
Питома електрична провідність електроліту – електрична провідність розчину об’ємом 1 м3, що міститься між двома паралельними електродами, площа кожного з яких становить 1 м2.
Питома електрична провідність являє собою струм, який переноситься через одиницю поперечного перерізу при градієнті потенціалу 1 В/м. Питома електрична провідність визначається швидкістю руху іонів (рухливістю), їх концентраціями в розчині і температурою.
Еквівалентна електрична провідність (молярна) визначається як електрична провідність розчину, в об’ємі якого міститься 1 г-екв розчиненого електроліту і який розміщений між двома паралельними металевими провідниками, віддаленими один від одного на 1 м, [См×м2 /моль].
 (4.4)
(4.4)
де j = 1/С -розведення, тобто число літрів розчину, в якому міститься 1 г-екв розчиненої речовини. Враховуючи швидкість руху іонів (катіонів та аніонів) 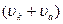 , ступінь дисоціації електроліту
, ступінь дисоціації електроліту  , коефіцієнт електропровідності
, коефіцієнт електропровідності  , можна записати:
, можна записати:
 (4.5)
(4.5)
де F - стала Фарадея
Прийнявши до уваги, що рухливість катіонів  іаніонів
іаніонів  , маємо
, маємо
 (4.6)
(4.6)
Залежність від концентрації наведена на рис.4.1.
Питома електрична провідність розчинів зростає зі збільшенням концентрації електролітів до певної межі, тому що в 1 мл об’єму збільшується кількість переносників електричного струму – іонів. Як видно з рис.4.1, для слабких електролітів при деякій концентрації питома електрична провідність зменшується, тому що зменшується ступінь їх дисоціації.
 Рис. 4.1. Залежність питомої електричної провідності від концентрації розчину сильного та слабкого електроліту
Рис. 4.1. Залежність питомої електричної провідності від концентрації розчину сильного та слабкого електроліту
| Для сильних електролітів зі збільшенням концентрації зменшується відстань між іонами, внаслідок чого зростає взаємне гальмування за рахунок наявності електрофоретичного та асиметричного ефектів і, відповідно, зменшується швидкість руху іонів. Крім того, зі збільшенням концентрації електроліту зростає в’язкість розчину, що також гальмує рух іонів. |
 Рис. 4.2. Залежність еквівалентної електричної провідності від розведення розчину
Рис. 4.2. Залежність еквівалентної електричної провідності від розведення розчину
| Еквівалентна електрична провідність слабких і сильних електролітів (рис. 4.2) збільшується з розведенням: для слабких – внаслідок збільшення ступеню дисоціації електроліту, для сильних – внаслідок зростання рухливості іонів. |
Date: 2016-01-20; view: 759; Нарушение авторских прав