
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Порядок виконання роботи. 1. В склянку заливають 200 г води
|
|
1. В склянку заливають 200 г води.
2. Розраховують кількість KNO3, що припадає на 200 г води, для одержання розчину концентрацією 0,2 - 0,3 Μ.
3. Для визначення маси наважки зважують порожню пробірку, а потім пробірку разом із сіллю з точністю до 0,01 г.
4. Збирають калориметричну установку як показано на рис.1.1.
5. Проводять вимірювання зміни температури у калориметричній системі, яка відбувається внаслідок розчинення солі. При безперервному перемішуванні розчину фіксують зміну температури з точністю до 0,1 °С через кожні 30 с і заносять у робочий зошит. Для визначення точної зміни температури під час досліду процес розчинення умовно поділяють на три періоди:
а) Попередній, який триває до 5 хв.
б) Головний – процес розчинення солі.
в) Заключний – до 5 хвилин.
 Рис. 1.2. Графічне визначення температурного перепаду в калориметрі
Рис. 1.2. Графічне визначення температурного перепаду в калориметрі
| У попередньому періоді визначають інтенсивність теплообміну калориметра з навколишнім середовищем. Для цього при безперервному перемішуванні води вимірюють її температуру через кожні 30 с. Після встановлення сталої температури, тобто зміна температури через кожні 30 с буде майже однакова (через 5 хв вимірювань), у склянку з водою вносять сіль. |
В головному періоді не припиняють перемішування розчину до повного розчинення солі, фіксуючи зміну температури кожні 30 с.
Заключний період прийнято вважати з моменту досягнення рівноваги розчинення солі, тобто з моменту припинення зниження температури (тривалість не менше 5 хв).
6. Зміну температури в системі, яка відбувається внаслідок розчинення солі визначають графічно. Для цього на міліметровому папері, будують графік, де на вісі абсцис відкладають час, а на вісі ординат – температуру. На рис. 1.2 показано одну з можливих діаграм, де FА – попередній період, AD – головний і DС – заключний. Для визначення Δ Τ продовжують (пунктиром) лінію попереднього періоду вправо (ділянка АВ), а лінію заключного періоду вліво (ділянка ОD). Через середину головного періоду (точка К) проводять пряму, паралельну вісі ординат, до перетину з пунктирними лініями. Відстань ОВ дорівнює зміні температури D Τ при розчиненні солі з урахуванням теплообміну між калориметром і навколишнім середовищем.
7. Після розчинення солі за зміною температури розчину в калориметрі визначають кількість теплоти, наданої системі (калориметричний тепловий ефект).
Опрацювання результатів
Калориметричний тепловий ефект розраховують за рівнянням:
 (1.10)
(1.10)
де Сp-н – питома теплоємність розчину; mр-н – маса розчину, W – стала калориметра або водяний еквівалент; Dt – зміна температури розчину в процесі розчинення.
Водяний еквівалент калориметра (W) являє собою теплоємність калориметричної системи, тобто кількість теплоти, необхідної для нагрівання або охолодження всіх частин калориметра на один градус:
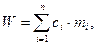 (1.11)
(1.11)
де Σ m – маса частин калориметра, що беруть участь в теплообміні; cj – питома теплоємність кожної частини калориметра. Отже, водяний еквівалент можна визначити з (1.11) як суму добутків теплоємності кожної з частин калориметра на її мacy крім теплоємності розчину.
Сталу калориметра можна визначити за рівнянням (1.10), якщо ввести в калориметр відому кількість теплоти. Калориметричний тепловий ефект для солі KNO3 ( Q KNO3 ) обчислюють за відомою інтегральною теплотою розчинення DH= 35,6 кДж/моль. Калориметричний тепловий ефект для солі KNO3 буде:
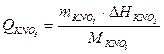 (1.12)
(1.12)
Підставивши отримане значення у формулу (1.10) визначають сталу (водяний еквівалент) калориметра за експериментально визначеним значенням Δ ΤКNO3:
 (1.13)
(1.13)
де cp – питома теплоємність розчину, яка визначається за питомою теплоємністю води, оскільки розчин розбавлений (при 298 К вона становить 4,18 Дж/г×К).
Лабораторна робота № 1.2
Date: 2016-01-20; view: 534; Нарушение авторских прав