
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Растворы нелетучих веществ в летучих растворителях
|
|

рA0 – давление насыщенного пара над чистым растворителем.
рA – давление насыщенного пара над раствором.
Давление насыщенного пара рA0 над растворителем или жидкостью определяется межмолекулярным взаимодействием внутри жидкости. Чем больше сила взаимодействия fA-A между молекулами, тем меньше пара над жидкостью, и соответственно, тем меньше давление этого пара рA0 <<<.
Давление насыщенного пора над раствором рA при нелетучем растворенном веществе В отличается от давления насыщенного пара над чистым растворителем рA0. Для нахождения этого отличия в зависимости от состава идеального раствора рассмотрим условия равновесия i -го компонента в растворе и в парообразном состоянии. Это равновесие определяется равенством химических потенциалов:
 , где
, где
 – химические потенциалы i -го компонента в растворе и в парообразном состоянии.
– химические потенциалы i -го компонента в растворе и в парообразном состоянии.
Химический потенциал можно выразить через парциальное давление:

Если i -й компонент подчиняется законом идеальных газов, то дифференцируя это уравнение, получим:
 (*)
(*)
Теперь из уравнений  и (*) выразим изменения мольной доли растворенного вещества следующим образом:
и (*) выразим изменения мольной доли растворенного вещества следующим образом:

Проведем интегрирование этого уравнения от рA0 до рA и от NA=1 до NA, изменяющегося в пределах 0<NA<1, где NA – мольная доля растворителя в растворе; для чистого растворителя NA=1,
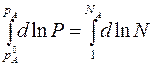
После интегрирования получаем:


 (1) (*)
(1) (*)
Давление насыщенного пара над раствором рA равно произведению его давления над чистым растворителем рA0 на его мольную долю NA.
Если раствор состоит из двух компонентов А(р-ль) и В(в-во), то мольная доля растворенного вещества равна NB=1-NA. Тогда уравнение (*) трансформируется:
Если NВ – мольная доля растворенного вещества, то
 (2) (**)
(2) (**)
Формулы (*) и (**) отражают различные способы выражения закона Рауля.
Разность (рA0- рA) характеризует понижение давления насыщенного пара над раствором, а отношение (рA0- рA)/ рA0 – относительное понижение давления насыщенного пара.
Тогда закон Рауля формулируется следующим образом: относительное понижение давления пара над раствором равно мольной доле растворенного вещества в растворе.

Закон Рауля применим к идеальным и сильно разбавленным растворам.
Максимальное давление пара, создаваемое жидкостью – давление её насыщенного пара при данной температуре.
ДНП растет с температурой.
Когда ДНП становится равным внешнему давлению, жидкость закипает.
Пример. Вычислим давление пара при 373 К (100 0С) над водным раствором сахарозы, мольная доля которой составляет NB=1,01∙10-3, для воды рA0=1,013∙105 Па.
Согласно уравнению (**)

Как следует из полученных данных, над раствором сахарозы происходит весьма незначительное снижение давления насыщенного пара воды по сравнению с чистой водой.
Date: 2016-02-19; view: 517; Нарушение авторских прав