
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Лекарственные препараты на основе олигонуклеотидов
|
|
В большинстве методов генной терапии ех vivo и in vivo используются клонированные генетические конструкции, возмещающие функциональную форму белка, который не синтезируется в организме больного или синтезируется в дефектной форме. Однако многие заболевания человека (рак, воспаления, вирусные и паразитарные инфекции) связаны, напротив, с гиперпродукцией нормального белка. Для лечения таких состояний разработаны терапевтические
системы с использованием специфических олигонуклеотидов. Такой небольшой олигонуклеотид может гибридизоваться со специфическим геном или мРНК и снижать уровень транскрипции или трансляции, уменьшая тем самым количество синтезируемого белка, ответственного за патологию. Олигонуклеотид, который гибридизуется с самим геном и блокирует его транскрипцию, называется «антигенным», а тот, который гибридизуется с соответствующей мРНК, - «антисмысловым» (Antisense RNA). Для предотвращения активации транскрипции специфических генов можно так-же использовать двухцепочечные олигонуклеотиды, специфично присоединяющиеся к ДНК-связывающим белкам (белкам-активаторам). Наконец, для уменьшения количества определенной мРНК и синтезируемого на ней белка можно использовать рибозимы - природные РНК-последовательности, которые связываются со специфическими молекулами РНК и разрезают их.
В будущем лекарственные средства на основе нуклеиновых кислот, по-видимому, найдут широкое применение, при этом главным объектом научных исследований и клинических испытаний будут различные «антисмысловые» олигонуклеотиды.
3.1..«Антисмысловые» олигонуклеотиды как лекарственные средства
«Антисмысловая» РНК (Antisense RNA), которую предполагается использовать в качестве лекарственного средства, представляет собой короткий (15-20-нуклеотидов) олигонуклеотид, который может связываться с комплементарным ей определенным участком мРНК и ингибировать трансляцию кодируемого ей белка, подавляя тем самым патологический процесс (рис.2).
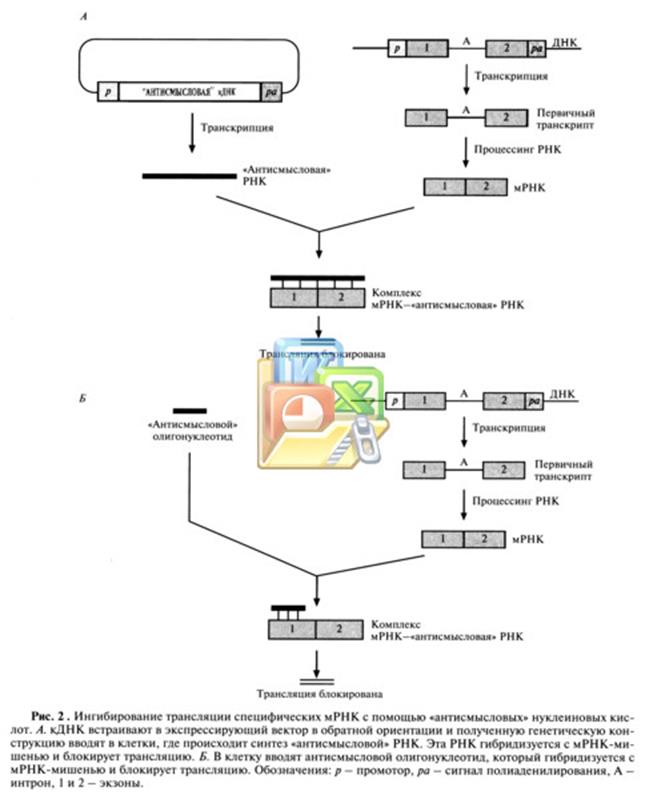
Терапевтический эффект синтетических «антисмысловых» олигонуклео-тидов зависит от специфичности их гибридизации с доступным сайтом мРНК-мишени, устойчивости к действию клеточных нуклеаз и наличия системы доставки в клетку. 15-20-нуклеотидные последовательности гибридизуются с уникальными мРНК с достаточно высокой специфичностью. Потенциальные сайты-мишени определяют тестированием набора «антисмысловых» олигонуклеотидов с использованием культуры клеток, синтезирующих мРНК-мишень. Для этого проводят электрофоретическое разделение клеточных белков, в которые включают радиоактивную метку во время трансляции, и с помощью радиоавтографии устанавливают, в присутствии какого из «антисмысловых» олигонуклеотидов снижается синтез определенного белка. Никаких общих критериев выбора наилучших сайтов-мишеней в разных РНК-транскриптах не существует. Эффективными могут оказаться олигонуклеотиды, комплементарные 5'- или 3'-концам мРНК, границам экзонов и интронов и даже двухцепочечным областям. Антисмысловые олигонуклеотиды могут разрушаться внутриклеточными нуклеазами, поэтому важно защитить их от действия последних так, чтобы они не утратили способности к гибридизации с мишенью. Для этого можно модифицировать определенным образом пиримидиновые основания, рибозу или дезоксирибозу (рис.3). Так, у наиболее широко применяющихся сейчас «антисмысловых» олигонуклеотидов свободный атом кислорода фосфодиэфирной связи заменен на группу SH (рис. 3Б ), в результате чего образуется тиофосфатная связь. Модифицированные таким образом олигонуклеотиды растворяются в воде, несут отрицательный заряд и не расщепляются под действием эндонуклеаз. При гибридизации с сайтом-мишенью они образуют дуплексы, которые активируют рибонуклеазу (РНКазу), эндогенный фермент, расщепляющий мРНК в такой гибридной молекуле. Проведены первые клинические испытания таких олигонуклеотидов — лекарственных средств «первого поколения». Мишенями являются РНК цитомегаловируса, вируса иммунодефицита человека, а также мРНК генов, ответственных за развитие рака, болезней кишечника и других заболеваний.
Синтезированы «антисмысловые» олигонуклеотиды с фосфорамидитной и полиамидной (пептидной) связями - пептидные нуклеиновые кислоты (Peptide nucleicacids, PNAs) (рис.3 В и Г ). Такие молекулы очень устойчивы к действию нуклеаз. Химические группы, присоединенные к 2'-углеродному атому сахарного остатка и С-5-атому пиримидинов, также защищают «антисмысловые» олигонуклеотиды и облегчают их связывание с сайтом-мишенью (рис. 3 2 Д и Е ). Все преимущества этих и других модификаций сейчас интенсивно изучаются.
Проникновение «антисмыловых» олигонуклеотидов в клетку можно значительно облегчить, поместив их в липосомы. Такая высокоэффективная система доставки позволяет использовать «антисмысловые» олигонуклеотиды в небольших концентрациях. Если же конъюгировать липосомы с антителами, специфичными к эпитопам определенных клеток тех или иных органов, то можно будет осуществлять адресную доставку «антисмысловых» олигонуклеотидов.
Проведенные доклинические испытания оказали, что «антисмысловые» олигонуклеотиды являются весьма эффективными лекартвенными средствами. Изучена возможность их применения для лечения стеноза коронарых и сонных артерий, который приводит к инфарктам и инсультам. В этих случаях часто прибегают к ангиопластике, расширению артерий с помощью баллонного катетера, но примерно у 40% больных через 6 месяцев вновь возникают стенозы, поскольку ангиопластика стимулирует пролиферацию гладкомышечных клеток и секрецию межклеточного вещества во внутренний слой артерии в месте ее расширения. В одном из экспериментов в сонные артерии крыс после ангиопластики вводили антисмысловые» олигонуклеотиды с тиофосфатными связями, комплементарные мРНК, которые кодируют важные для клеточного циклa млекопитающих белки; в результате частота повторных стенозов уменьшилась на 90%. Пролиферация гладкомышечных клеток происходит также при атеросклерозе, сахарном диабете, осложнениях после коронарного шунтирования. Вероятно, все эти состояния можно будет контролировать аналогичными способами.

«Антисмыловые» олигонуклеотиды можно применять и для лечения вирусных инфекций и малярии. Кроме того, результаты I фазы клинических испытаний лечения болезни Крона с помощью орального введения «антисмыслового» олигонуклеотида проиллюстрировали четко выраженный терапевтический эффект без заметных побочных эффектов. В этом случае мРНК-мишень кодировала межклеточный адгезии типа 1, который вырабатывается в избытке у пациентов с болезнью Крона. Предполагается исследовать эффективность этого же олигонуклеотида для терапии других воспалительных заболеваний, например ревматоидного артрита, псориаза и язвенного колита.
В принципе «антисмысловые» олигонуклеотиды могут образовывать тройную спираль с хромосомной ДНК-мишенью и блокировать транскрипцию. Однако пока специфичность «антигенных» олигонуклеотидов не соответствует стандартам, принятым для лекарственных средств.
Date: 2016-02-19; view: 1112; Нарушение авторских прав