
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Представление о путях синтеза и распада сфинголипидов
|
|
Сфинголипиды, подобно глицерофосфолипидам, не являются незаменимыми компонентами пищи и могут синтезироваться из других соединений. Для их синтеза нужен в первую очередь сфингозин, который образуется в ходе нескольких последовательных реакций из пальмитоил-КоА и серина; необходимы активированные жирные кислоты в виде ацил-КоА-производных; необходимы также или активированный холин в виде ЦДФ-холина для синтеза сфингомиелинов, или активированные мономеры углеводной природы в виде их УДФ-производных для синтеза цереброзидов или ганглиозидов. При синтезе ганглиозидов активированной формой сиаловой кислоты является ее ЦДФ-производное.
Расщепление сфинголипидов в клетках происходит в лизосомах при участии имеющихся в этих органеллах различных кислых лизосомальных гидролаз. Углеводные компоненты гликосфинголипидов расщепляются при участии различных лизосомальных гликозидаз. Сфингомиелин расщепляется на церамид и фосфорилхолин при участии сфингомиелиназы. Образовавшийся же при деградации различных сфинголипидов церамид гидролизуется при участии церамидазы на сфингозин и высшую жирную кислоту. Продукты деградации поступают из лизосом в цитозоль, где они могут использоваться в биосинтезах или расщепляться до конечных продуктов.
3.4. Обмен холестерина. ХС содержится в организме либо в виде свободного ХС либо в виде эфиров с длинноцепочечными жирными кислотами.
ХС синтезируется из ацетил-КоА во многих тканях, но главным образом в печени (~50%), в кишечнике (~15%) и в коже. А выводится Х из организма с желчью в виде свободного ХС либо в виде солей желчных кислот.
ХС является чрезвычайно важным для организма соединением:
1) Из него синтезируются другие очень важные стероиды, а именно, кортикостероидные гормоны, половые стероидные гормоны, желчные кислоты, витамин D.
2) ХC входит в состав наружного слоя ЛП плазмы крови.
3) ХC входит в состав всех клеточных мембран. От ХС зависит вязкость (или микровязкость) мембран, а от микровязкости мембран, в свою очередь зависит следующее:
а) функционирование мембранных белков;
б) свойства рецепторных белков,
в) активность ферментов, которые расположены в той или иной мембране.
г) от микровязкости зависит сопротивляемость мембран действию электрического тока. При снижении этой сопротивляемости происходит так называемый "электрический пробой". Ток проходит через мембрану, мембрана разрушается, теряет ионы натрия, кальция, другие ионы.
д) от микровязкости зависит деление клеток,
е) дифференцировка,
ж) межклеточные взаимодействия.
Приблизительно половина ХC, имеющегося в организме, образуется в самом организме путем биосинтеза, а другая половина поступает с пищей.
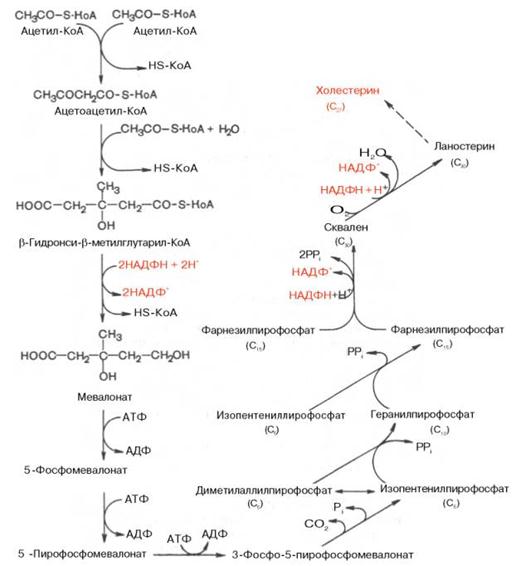
Путь биосинтеза холестерина: В синтезе холестерина можно выделить три основные стадии:
I – превращение активного ацетата в мевалоновую кислоту,
II – образование сквалена из мевалоновой кислоты,
III – циклизация сквалена в холестерин. Рассмотрим 1 стадию превращения активного ацетата в мевалоновую кислоту. Начальным этапом синтеза мевалоновой кислоты из ацетил-КоА является образование ацетоацетил-КоА посредством обратимой тиолазной реакции:
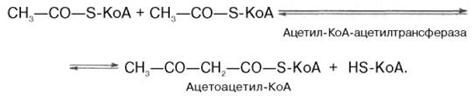
Затем при последующей конденсации ацетоацетил-КоА с 3-й молекулой ацетил-КоА при участии гидроксиметилглутарил-КоА-синтазы (ГМГ-КоА-синтаза) образуется β-гидрокси-β-метилглутарил-КоА:
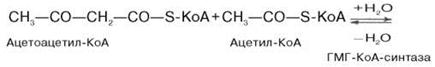
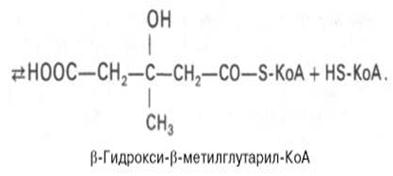
Далее β-гидрокси-β-метилглутарил-КоА под действием регуляторно-го фермента НАДФ-зависимой гидроксиметилглутарил-КоА-редуктазы (ГМГ-КоА-редуктаза) в результате восстановления одной из карбоксильных групп и отщепления HS-KoA превращается в мевалоновую кислоту:
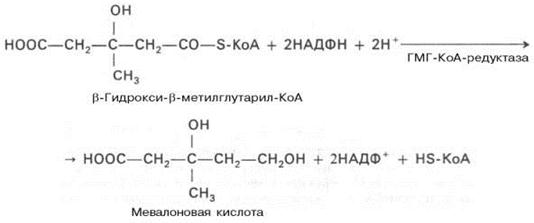
ГМГ-КоА-редуктазная реакция – первая практически необратимая реакция в цепи биосинтеза холестерина. Она протекает со значительной потерей свободной энергии (около 33,6 кДж). Установлено, что данная реакция лимитирует скорость биосинтеза холестерина. Наряду с классическим путем биосинтеза мевалоновой кислоты имеется второй путь, в котором в качестве промежуточного субстрата, по-видимому, образуется не β-гидрокси-β-метилглутарил-КоА, а β-гидрокси-β-метилглутарил-S-АПБ. Реакции этого пути идентичны начальным стадиям биосинтеза жирных кислот вплоть до образования ацетоацетил-S-АПБ. В образовании мевалоновой кислоты по этому пути принимает участие ацетил-КоА-карбоксилаза–фермент, осуществляющий превращение ацетил-КоА в малонил-КоА. Оптимальное соотношение малонил-КоА и ацетил-КоА для синтеза мевалоновой кислоты–2 молекулы ацетил-КоА на 1 молекулу малонил-КоА. Участие малонил-КоА–основного субстрата биосинтеза жирных кислот в образовании мевалоновой кислоты и различных полиизопреноидов показано для ряда биологических объектов: печени голубя и крысы, молочной железы кролика, бесклеточных дрожжевых экстрактов. Этот путь биосинтеза мевалоновой кислоты отмечен преимущественно в цитозоле клеток печени. Существенную роль в образовании мевалоната в данном случае играет ГМГ-КоА-редуктаза, обнаруженная в растворимой фракции печени крысы и неидентичная микросомному ферменту по ряду кинетических и регуляторных свойств. Регуляция второго пути биосинтеза мевалоновой кислоты при ряде воздействий отличается от регуляции первого пути, в котором принимает участие микросомная редуктаза. Эти данные свидетельствуют о существовании двух автономных систем биосинтеза мевалоновой кислоты. Физиологическая роль второго пути окончательно не изучена. На II стадии синтеза холестерина мевалоновая кислота превращается в сквален. Реакции II стадии начинаются с фосфорилирования мевалоновой кислоты с помощью АТФ. В результате образуется 5-фосфорный эфир, а затем 5-пирофосфорный эфир мевалоновой кислоты:
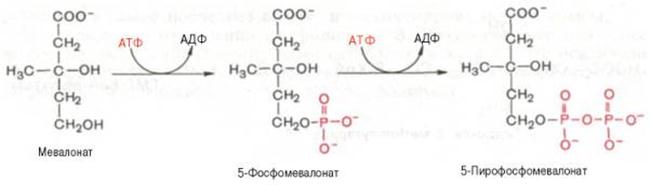
5-пирофосфомевалоновая кислота в результате последующего фосфо-рилирования третичной гидроксильной группы образует нестабильный промежуточный продукт–3-фосфо-5-пирофосфомевалоновую кислоту, которая, декарбоксилируясь и теряя остаток фосфорной кислоты, превращается в изопентенилпирофосфат. Последний изомеризуется в диметил-аллилпирофосфат:
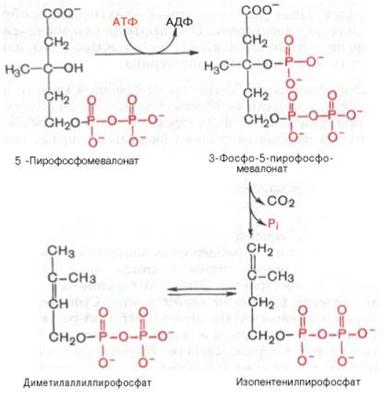
Затем оба изомерных изопентенилпирофосфата (диметилаллилпирофос-фат и изопентенилпирофосфат) конденсируются с высвобождением пи-рофосфата и образованием геранилпирофосфата:
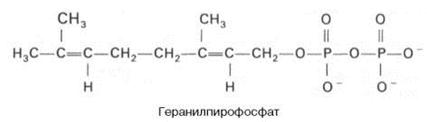
К геранилпирофосфату вновь присоединяется изопентенилпирофосфат. В результате этой реакции образуется фарнезилпирофосфат:
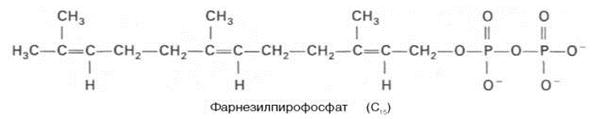
В заключительной реакции данной стадии в результате НАДФН-за-висимой восстановительной конденсации 2 молекул фарнезилпирофосфата образуется сквален:
На III стадии биосинтеза холестерина сквален под влиянием сквален-оксидоциклазы циклизируется с образованием ланостерина. Дальнейший процесс превращения ланостерина в холестерин включает ряд реакций, сопровождающихся удалением трех метильных групп, насыщением двойной связи в боковой цепи и перемещением двойной связи в кольце В из положения 8, 9 в положение 5, 6 (детально эти последние реакции еще не изучены). См. схему синтеза холестерина ниже.
У людей содержание ХС в плазме крови составляет около 200 мг/100мл крови. ЛПНП являются главной транспортной системой ХС. Именно ЛПНП переносят ХС в другие ткани, где синтез ХС не такой активный, как в печени. ЛПНП захватываются клетками с помощью специальных рецепторов. Внутри клеток (в лизосомах) ЭХ подвергаются действию ХЭ-азы, освобождается свободный ХС, который используется клетками для разных нужд: для построения мембран или для специфических функций: в печени из ХС синтезируются желчные кислоты, в коже - витамин D3, в надпочечниках - стероидные гормоны. Кроме того, все клетки нуждаются в ХС для построения своих мембран. Если клетка не использует ХС, то он снова превращается в ЭХС с помощью фермента АХАТ. АХАТ переносит на свободный ХС ацильный остаток с активной формы ВЖК. При этом образуются эфиры ХС. В таком виде ХС запасается клеткой. ЭХ - транспортная и депонируемая форма ХС. В конечном итоге весь ХС, который должен быть выведен из организма, поступает в печень и экскретируется с желчью либо в виде ХС, либо в виде солей желчных кислот. Из организма человека ежедневно выводится около 1г ХС. Приблизительно половина этого количества экскретируется с фекалиями после превращения в желчные кислоты, оставшаяся часть выводится в виде нейтральных стероидов.
Биосинтез желчных кислот: первичные ЖеК синтезируются в печени из ХС - это холевая и хенодезоксихолевая кислоты. Главным ферментом в этом процессе является 7-альфа-гидроксилаза. В этой реакции участвует О2, НАДФН2 и цитохром Р-450. При недостатке аскорбиновой кислоты (витамин С) образование ЖеК тормозится, это приводит к накоплению ХС и атеросклерозу.
В норме ЖеК поступают в желчь в виде конъюгатов с глицином и таурином (NH2-CH2-CH2-SO3H). При этом образуются гликохолевая и таурохолевая кислоты. В кишечнике часть первичных ЖеК под действием кишечных бактерий превращается во вторичные ЖеК: из холевой кислоты образуется - дезоксихолевая, из хенодезоксихолевой - литохолевая кислота.
Из организма человека ежедневно выводится около 1г Х. Приблизительно половина этого количества экскретируется с фекалиями после превращения в желчные кислоты. Оставшаяся часть выводится в виде нейтральных стероидов.
Другие продукты метаболизма ХС:
1) ХС является предшественником стероидных гормонов в половых железах и коре надпочечников.
2) При всасывании ХС в кишечнике часть его превращается в 7-дегидроХС. Это молекула ХС, у которой в 7-м положении отнимается водород. Такое же превращение происходит также в коже и некоторых других тканях. В коже накапливается запас 7-дегидрохолестерина, из которого под влиянием УФО образуется витамин Д3.
Ключевая роль в регуляции синтеза ХС в клетках принадлежит ферменту ГМГ-КоА-редуктазе. При повышении содержания ХС в клетке, вне зависимости от того, синтезирован он в данной клетке или поступил в клетку извне, происходит снижение ГМГ-КоА-редуктазной активности в клетке. Установлено, что в данном случае речь не идет о прямом влиянии ХС на активность фермента, в основе ингибирующего эффекта лежат другие механизмы. В литературе обсуждается несколько вариантов этих механизмов:
Во-первых, ГМГ-КоА-редуктаза встроена в мембраны эндоплазматической сети, в связи с чем накопление ХС в этих мембранах может привести к конформационным изменениям мембраны, а, следовательно, и к изменению конформации фермента, понижающему его активность.
Во-вторых, накопление ХС в клетке приводит к увеличению содержания в ней гидроксипроиз водных ХС, последние в комплексе с белком-переносчиком проникают в ядро и там угнетают транскрипцию гена, ответственного за синтез ГМГ-КоА-редуктазы. Угнетение транскрипции гена приводит к снижению количества фермента в клетке и торможению синтеза ХС.
В третьих, активность ГМГ-КоА-редуктазы может регулироваться путем фосфорилирования - дефосфорилирования фермента при участии цАМФ-зависимой пртеинкиназы и фосфопротеинфосфатазы, однако в последнем случае речь идет не о внутриклеточной регуляции синтеза ХС, а об изменение активности фермента в ответ на внешний регуляторный сигнал, например в ответ на появление в окружающей среде того или иного гормона.
Date: 2015-05-22; view: 1343; Нарушение авторских прав