
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Периодическая система Д. И. Менделеева
|
|
Периодичный закон, открытый Д.И. Менделеевым в 1869 г., в современной формулировке гласит:
свойства химических элементов, а также формы и свойства образуемых ими соединений находятся в периодической зависимости от величины заряда ядер их атомов.
Заряд ядра (число протонов) равен атомному номеру элемента, определяет число электронов в атоме и, как следствие этого, строение его электронной оболочки в основном состоянии.
Графическим изображением периодического закона является таблица периодической системы элементов. Формы такого изображения различны.
Принципиальный подход к построению таблиц единый – элементы располагаются в порядке возрастания заряда ядер их атомов. Физической основой структуры периодической системы элементов служит определенная последовательность формирования электронных конфигураций атомов по мере роста порядкового номера элемента Z.
В зависимости от того, какой энергетический подуровень заполняется электронами последним, различают 4 типа элементов:
1. s–элементы – последним заполняется s-подуровень внешнего энергетического уровня;
2. p–элементы – p–подуровень внешнего энергетического подуровня;
3. d – элементы – d–подуровень предпоследнего энергетического уровня.
4. f–элементы – f–подуровень третьего снаружи уровня.
Элементы со сходной электронной конфигурацией (заполняются однотипные подуровни) внешних энергетических уровней обладают и сходными химическими свойствами.
Периодом называется последовательный ряд элементов, электронная конфигурация внешнего энергетического уровня которых изменяются от ns1 до ns2np6 (для первого периода s1 и s2). При этом номер периода совпадает со значением главного квантового числа и внешнего энергетического уровня.
Каждый из периодов (исключая первый) начинается типичным металлом и заканчивается благородным газом, которому предшествует неметалл, то есть в периоде с увеличением заряда ядра атомов наблюдается постепенное изменение свойств от металлических к типично неметаллическим, что связывается с увеличением числа электронов на внешнем энергетическом уровне.
Первые три периода создают s- и p- элементы. Четвертый и последующие - включают в свой состав также элементы, у которых происходит заполнение d- и f-подуровней соответствующих внутренних энергетических уровней. f-элементы объединяются в семейства, называемые лантанидами (4f-элементы) и актинидами (5f-элементы).
В вертикальных колонках, называемых группами, объединены элементы, имеющие сходное электронное строение. В короткопериодном варианте таблицы всего 8 групп, каждая из которых состоит из главных и побочных подгрупп. У элементов главных подгрупп последними заполняются s- и p- подуровни внешних энергетических уровней, электронные конфигурации которых являются основным фактором, определяющим химические свойства элементов. У элементов побочных подгрупп происходит заполнение внутренних (n-1)d- и (n-2)f-подуровней при наличии на внешнем энергетическом уровне 1 – 2 электронов.
Элементы-аналоги имеют одинаковое строение внешних электронных оболочек атомов при разных значениях главного квантового числа n и поэтому проявляют сходные химические свойства.
Таким образом, при последовательном увеличении зарядов атомных ядер периодически повторяется конфигурация электронных оболочек и, как следствие, периодически повторяются химические свойства элементов. В этом заключается физический смысл периодического закона.
Элементы главных и побочных подгрупп различаются своими химическими свойствами, однако им присуще и общее, что объединяет их в одну группу - номер группы. Он, как правило, указывает на число электронов, которое может участвовать в образовании химических связей. В этом состоит физический смысл номера группы.
Таким образом, у элементов главных подгрупп валентными (то есть участвующими в образовании химических связей) являются электроны внешнего энергетического уровня, а у элементов побочных подгрупп – и электроны предпоследних уровней. Это основное различие между элементами главных и побочных подгрупп.
Поскольку электронная конфигурация атомов химических элементов изменяется периодически с ростом заряда их ядер, все свойства, определяемые электронным строением, закономерно изменяется по периодам и группам периодической системы. К таким свойствам относятся прежде всего различные химические и физические характеристики элементов: атомные и ионные радиусы, сродство к электрону, степень окисления, атомный объем и др. Периодически изменяются также многие химические и физические свойства простых и сложных веществ, образованных элементами–аналогами.
Атом не имеет строго определенную границу, поэтому установить его абсолютные размеры невозможно. Различают следующие радиусы атомов.
Ковалентный радиус представляет собой половину межъядерного расстояния в молекулах или кристаллах соответствующих простых веществ.
Металлический радиус равен половине расстояния между центрами двух соседних атомов кристаллической решетки металла.
Кроме того, различают ионные радиусы катионов, которые всегда меньше атомных радиусов соответствующих элементов, и радиусы анионов, которые больше атомных радиусов.
Орбитальный радиус – теоретически рассчитанное расстояние от ядра до главного максимума электронной плоскости главной орбитали.
Закономерности изменения рассматриваемых параметров в системе элементов имеет периодический характер. Наиболее общие из них следующие:
- в периодах по мере роста заряда ядер радиусы атомов уменьшаются;
- в группах с ростом заряда ядер радиусы атомов увеличиваются, при этом в группах А такое увеличение происходит в большей степени, чем в группах В.
Химическая активность элемента определяется способностью его атомов терять или приобретать электроны. Количественно это оценивается энергией ионизации Еион атомов (или потенциалом ионизации I) и его сродством к электрону Еср.
Энергия ионизации – минимальная энергия, необходимая для отрыва наиболее слабосвязанного электрона от невозбужденного атома (э - элемент):
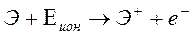 .
.
Энергия ионизации выражается в килоджоулях на моль (кДж/моль) или в электрон-вольтах на атом (эВ/ат).
Наименьшее напряжение электрического поля, при котором происходит отрыв электрона, называется потенциалом ионизации I (выражается в вольтах - В). Численное значение I в вольтах равно энергии ионизации Еион. в электрон-вольтах.
Отрыву первого электрона соответствует первый потенциал ионизации I1, второго – I2, и т.д. При этом I1<I2<…
Потенциал ионизации является сложной функцией некоторых свойств атома: заряда ядра, радиуса атома, конфигурации внешних электронных оболочек.
Способность атома образовывать отрицательно заряженные ионы характеризуется сродством к электрону, под которым понимается энергетиский эффект присоединения электрона к нейтральному атому в процессе:
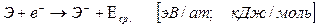 .
.
Наибольшим сродством к электрону характеризуются элементы группы VIIA. У большинства металлов и благородных газов сродство к электрону невелико или даже отрицательно. Присоединение двух или большего числа электронов к атому вообще невозможно.
Электроотрицательность 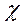 - условная величина, характеризующая способность атома в химическом соединении притягивать к себе электроны.
- условная величина, характеризующая способность атома в химическом соединении притягивать к себе электроны.
Для практической оценки этой способности атома введена условная относительная шкала электроотрицательности (ЭО). По такой шкале наиболее электроотрицательным среди элементов, способных образовывать химические соединения, является фтор, а наименее электроотрицательным – франций.
В периоде с ростом порядкового номера элемента ЭО возрастает, а в группе, как правило - убывает.
Date: 2015-05-22; view: 664; Нарушение авторских прав