
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Д – моноклинная; е – триклинная; [3, стр. 300]
|
|
В кубической системе все три оси имеют равную длину и пересекаются под углом 90°. Основные формы кубической системы – куб и октаэдр (рис. 2а). В этой системе кристаллизуется ~ 8% всех изученных кристаллов, например, многие металлы, алмаз, NaCl, KCl, один из основных минералов портландцемента 3CaO·Al2O3 [5, стр. 187] и др.
В гексагональной системе две оси имеют равную длину и находятся в одной плоскости под углом 60°, а третья располагается под углом в 90° и не равна им. Основные формы гексагональной системы – гексагональные призмы и бипирамида (рис. 2б). В этой системе кристаллизуется ~ 7% всех изученных кристаллов, например, многие химические элементы, H2O, SiO2, NaNO3, и др.
В тетрагональной системе все три оси пересекаются под углом 90°. Две из них имеют равную длину, а третья не равна им. Основные формы тетрагональной системы – квадратная призма и бипирамида с квадратным основанием (рис. 2в). В этой системе кристаллизуется ~ 5% всех изученных кристаллов, например Sn, SnO2 и др.
В ромбической системе все три оси пересекаются под углом 90°, но имеют различную длину. Основные формы ромбической системы – прямоугольная призма и бипирамида с прямоугольным основанием (рис. 2г). В этой системе кристаллизуется ~ 28% всех изученных кристаллов, например S, KNO3, K2SO4, один из основных минералов портландцемента 4CaO·Al2O3·Fe2O3 [5, стр. 23] и др.
В моноклинной системе две оси пересекаются под углом, отличающимся от 90°, а третья ось располагается под углом в 90° к этим двум осям. Все три оси имеют различную длину. Основные формы моноклинной системы – призма (четырехугольная) и бипирамида (рис. 2д). В этой системе кристаллизуется ~ 42% всех изученных кристаллов, например, S, KClO3, Na2SO4 ∙ 10H2O и др.
В триклинной системе все три оси имеют различную длину и располагаются под разными углами, отличающимися от 90°. Основные формы триклинной системы – призма и бипирамида (рис. 2е). В этой системе кристаллизуется ~ 10% всех изученных кристаллов, например K2Cr2O7, CuSO4 ∙ 5H2O, один из основных минералов портландцемента 3CaO·SiO2 [5, стр. 187] и др.
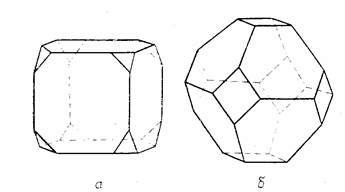 Из рис. 2 видно, в различных системах кристаллов повторяются основные геометрические формы – призмы и бипирамиды. Однако для естественных кристаллов характерны нее только основные формы, но и комбинации этих форм. Так, кристалл, изображённый на рис. 3а, является комбинацией куба и октаэдра, а кристалл, изображённый на рис. 3б, – комбинацией октаэдра и куба.
Из рис. 2 видно, в различных системах кристаллов повторяются основные геометрические формы – призмы и бипирамиды. Однако для естественных кристаллов характерны нее только основные формы, но и комбинации этих форм. Так, кристалл, изображённый на рис. 3а, является комбинацией куба и октаэдра, а кристалл, изображённый на рис. 3б, – комбинацией октаэдра и куба.
Кристаллические решётки образуются простыми веществами
Рис. 3. Комбинации основных форм кубической и химическими соединениями. В
системы: а – комбинация куба и октаэдра; зависимости от вида частиц,
б – комбинация октаэдра и куба [3, стр. 301]. образующих кристалл, существуют
решётки молекулярные (рис. 4), ионные (рис. 5,6), атомные (ковалентные) (рис. 7) и металлические (рис. 8).
Молекулярная решётка. В узлах решётки находятся молекулы вещества, связь между которыми осуществляется силами Ван-дер-Ваальса. Поэтому вещества, имеющие молекулярные решётки, обычно имеют низкие температуры плавления и кипения и большую летучесть (сера, йод, СО2)[6].
Ионная решётка. В узлах решётки находятся ионы 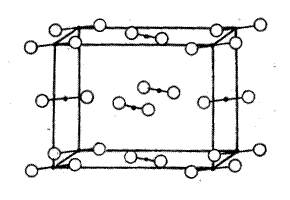 противоположных зарядов. Связь электростатическая. Кристаллы имеют относительно высокие температуры плавления и кипения (CsCl, NaCl)[7].
противоположных зарядов. Связь электростатическая. Кристаллы имеют относительно высокие температуры плавления и кипения (CsCl, NaCl)[7].
Атомная решётка. В узлах решётки расположены атомы элемента, образующего решётку, между которыми осуществляется ковалентная связь. Вещества имеют высокие температуры плавления, большую твёрдость и
малолетучи (алмаз)[8].
Рис. 4. Кристаллическая решётка йода [3, стр. 301].
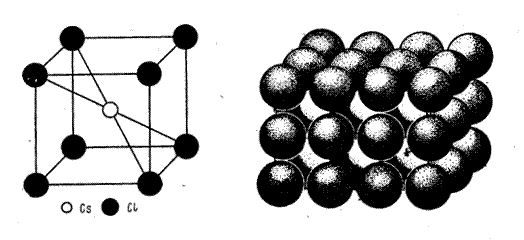
Рис. 5. Кристаллическая решётка CsCl [3, стр. 301].
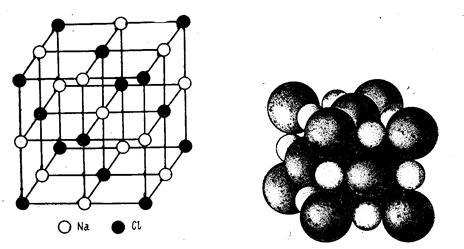
Рис. 6. Кристаллическая решётка NaCl [3, стр. 302].
Металлическая решётка. В узлах металлической решётки
находятся атомы и ионы металла, а в междоузлиях – свободные электроны, которые перемещаются по всему объёму кристалла и обусловливают характерные свойства металлов: пластичность, электропроводность, теплопроводность (Na, Cu, Mg).

Рис. 7. Кристаллическая решётка Рис. 8. Кристаллические решётки металлов:
Date: 2015-05-22; view: 921; Нарушение авторских прав