
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Выписываем: ключевые слова; неизвестные слова; непонятные слова
|
|
Ключевые слова:
Геометрическая форма молекул - это
Метод валентных связей- это
Орбитали, участвующие в образовании связей - это
Схема перекрывания
Метод валентных связей
Форматирование (распаривание) электронов
Донор электронов
Акцептор электронов
Донорно-акцепторная связь (стр 117 Гуров)
Гибридизация валентных орбиталей
Гибридные орбитали (рис. 4.7, 4.9, см. таблицу на стр. 119, Гуров)
Геометрические модели гибридных орбиталей
Геометрическая форма молекул, не содержащих кратные связи (табл.4.2.стр.125)
4)Изучаем теорию МВС:
Объяснение химической связи возникновением общих электронных пар между атомами легло в основу спиновой теории валентности, инструментом которой является метод валентных связей (МВС), открытый Льюисом в 1916 г.
Основные принципы образования химической связи по МВС:
(принципы метода валентных связей (стр. 115 Гуров))
1. Химическая связь образуется за счет валентных (неспаренных) электронов.
2. Электроны с антипараллельными спинами [1], принадлежащие двум различным атомам, становятся общими.
3. Химическая связь образуется только в том случае, если при сближении двух и более атомов полная энергия системы понижается.
4. Основные силы, действующие в молекуле, имеют электрическое, кулоновское происхождение.
5. Связь тем прочнее, чем в большей степени перекрываются взаимодействующие электронные облака.
Число электронов, обладающих «свободными» спинами, а следовательно и валентность атома, равно либо числу внешних электронов, не входящих в замкнутые оболочки, либо числу электронов, недостающих до завершения оболочки, в зависимости от того, какое из этих чисел меньше.
Согласно квантовой механике, взаимная ориентация спинов определяет характер движения электронов. При антипараллельных спинах электроны проводят сравнительно большое время между ядрами, так что средняя плотность отрицательного заряда оказывается достаточной для компенсации отталкивания ядер. При параллельных спинах эта плотность мала, и происходит отталкивание. Электроны с одинаково ориентированными спинами не могут разом втиснуться в промежуток между ядрами. Итак, связывающие состояния образует пара электронов, имеющих антипараллельные спины.
Электроны, образующие пары с антипараллельными спинами, в каждом из атомов не принимают участия в химической связи. Эту связь могут осуществлять лишь электроны со свободными спинами.
Существует два механизма образования ковалентной связи
Обменный механизм. Связь образована путем обобществления валентных электронов двух нейтральных атомов. Каждый атом дает по одному неспаренному электрону в общую электронную пару:
а б

Рис. 1. Обменный механизм образования ковалентной связи:
а – неполярной; б – полярной
Донорно-акцепторный механизм:
Один атом (донор) предоставляет электронную пару («дает пару», а другой атом (акцептор) предоставляет для этой пары свободную орбиталь- «принимает пару»).
Соединения, образованные по донорно-акцепторному механизму, относятся к комплексным соединениям

|
Рис. 2. Донорно-акцепторный механизм
образования ковалентной связи
Ковалентная связь имеет определенные характеристики.
Насыщаемость – свойство атомов образовывать строго определенное число ковалентных связей. Благодаря насыщаемости связей молекулы имеют определенный состав.
| Направленность – т. е. связь образуется в направлении максимального перекрытия электронных облаков. Относительно линии соединяющей центры атомов образующих связь различают: σ и π(рис. 3): σ-связь –образована перекрыванием АО по линии соединяющей центры взаимодействующих атомов; π-связь – это связь, возникающая в направлении оси перпендикулярной прямой, соединяющей ядра атома. Направленность связи обусловливает пространственную структуру молекул, т. е. их геометрическую форму. Гибридизация – это изменение формы некоторых орбиталей при образовании ковалентной связи для достижения более эффективного перекрывания орбиталей. Химическая связь, образуемая с участием электронов гибридных орбиталей, более прочная, чем связь с участием электронов негибридных s- и р-орбиталей, так как происходит большее перекрывание. Различают следующие виды гибридизации (табл. 1): sp-гибридизация – одна s-орбиталь и одна p-орбиталь превращаются в две одинаковые «гибридные» орбитали, угол между осями которых равен 180°. Молекулы, в которых осуществляется sp-гибридизация, имеют линейную геометрию (BeCl2). |
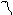

sp2-гибридизация – одна s-орбиталь и две p-орбитали превращаются в три одинаковые «гибридные» орбитали, угол между осями которых равен 120°. Молекулы, в которых осуществляется sp2-гибридизация, имеют плоскую геометрию (BF3, AlCl3).
sp3 - гибридизация – одна s-орбиталь и три p-орбитали превращаются в четыре одинаковые «гибридные» орбитали, угол между осями которых равен 109°28'. Молекулы, в которых осуществляется sp3-гибридизация, имеют тетраэдрическую геометрию (CH4, NH3).
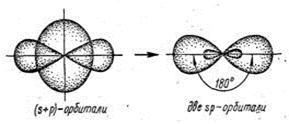
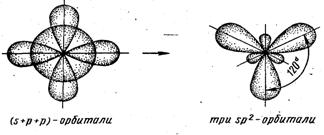
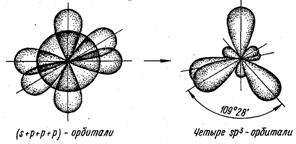
Виды гибридизаций валентных орбиталей: а – sp -гибридизация валентных орбиталей; б – sp2- гибридизация валентных орбиталей; в – sp 3-гибридизация валентных орбиталей
Date: 2015-05-22; view: 2603; Нарушение авторских прав