
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Теория Бора. 1. Правило квантования Бора
|
|
1. Правило квантования Бора
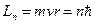
Согласно Бору в атоме водорода из всех орбит с моментами импульса электрона (см. таблицу)
| Номер орбиты | |||||
| Момент импульса (в ед.) | 6,0 | 5,5 | 4,2 | 3,5 | 2,6 |
стационарной является орбита с номером:
2. Обозначения электронных оболочек
l=0 – s оболочка
l=1 – p оболочка
l=2 – d оболочка
l=3 – f оболочка
3. Спектральные серии (Лаймана, Бальмера, Брэккета и т.д.)
Серия Лаймана – переходы на уровень 1
Серия Бальмера – переходы на уровень 2
Серия Пашена – переходы на уровень 3
Серия Брэккета – переходы на уровень 4
Серия Пфунда – переходы на уровень 5
Пример:
В атоме водорода из представленных переходов электрона: №1 (3d → 2s), №2 (2s → 1s), №3 (2p → 1s), №4 (4p → 2s), №5 (3p → 1s) первой линии серии Лаймана соответствует переход с номером
4. Формула Бальмера
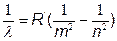
Пример:
По формуле Бальмера для водорода минимальная длина волны (в нм) первой линии серии Лаймана равна. (Серии могут быть разные)
5. Квантовые числа атома водорода. Число значений квантовых чисел
n = 1, 2 … - главное квантовое число
l = 0, 1, 2, … n-1 всего n чисел – орбитальное квантовое число
m = 0, ±1, ±2, … ±l всего 2l+1 чисел – магнитное квантовое число
Пример:
Чему равно число значений, принимаемых магнитным квантовым числом, для орбитального квантового числа l= 1.
6. Момент импульса электрона в атоме (квантовая теория)
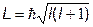
Пример:
Найти максимальное значение момента импульса электрона для главного квантового числа n= 5 (в ед. 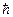 ). (Ответ: L = 4.47)
). (Ответ: L = 4.47)
7. Проекция момента импульса электрона в атоме
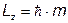
Пример:
Найти максимальное значение проекции момента импульса электрона для главного квантового числа n= 5 (в ед. 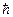 ). (Ответ: Lz =4)
). (Ответ: Lz =4)
8. Энергия электрона в атоме водорода. Энергия ионизации. Стационарные состояния
En=-Ei/n2
Пример:
Найти энергию электрона на втором стационарном уровне в атоме водорода (в эВ).
Какая из указанных Согласно Бору в атоме водорода из всех орбит с моментами импульса электрона (см. таблицу) стационарной является орбита с номером
| Номер орбиты | |||||
Момент импульса (в ед. 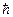 ) )
| 1,5 | 2,0 | 3,2 | 4,2 | 5,3 |
9. Излучение и поглощение энергии атомом
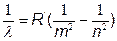
Eизл=En- Em
Пример:
Какова частота излучения при переходе электрона с уровня Е2 на уровень Е1 атома водорода(в 1015 Гц).
Электрона в атоме водорода переходит с уровня Е2 на уровень Е1. Какова энергия излученного фотона (в эВ).
10. Момент импульса электрона в состояниях s, p
Пример:
Какой момент импульса и максимальную проекцию момента импульса имеет электрон в s –состоянии?(в ед. 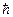 )
)
Какой момент импульса и максимальную проекцию момента импульса имеет электрон в p –состоянии?(в ед. 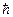 )
)
Какой момент импульса и максимальную проекцию момента импульса имеет электрон в d –состоянии?(в ед. 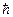 )
)
Какой момент импульса и максимальную проекцию момента импульса имеет электрон в g –состоянии?(в ед. 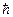 )
)
11. Правило отбора для переходов в атоме
Δl = ±1
Какой переход в энергетическом спектре атома водорода (рис.) является запрещенным
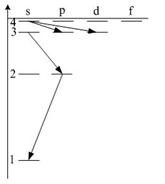
12. 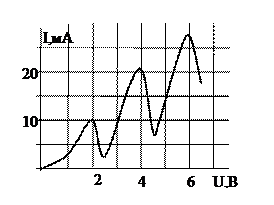 Опыт Франка-Герца
Опыт Франка-Герца
Пример:
Вольтамперная характеристика в опытах Франка и Герца полученная для некоторого газа имеет вид (см рис). Первый потенциал возбуждения газа (в эВ)
Date: 2015-05-19; view: 1499; Нарушение авторских прав