
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Плазменный гемостаз при ДВС-синдроме
|
|
Комплекс лабораторных показателей, характеризующих состояние активации плазменного

Рис. 147. Повреждение эндотелиального покрова при сепсисе грамотрицателы-юй бактериальной флорой, вызвавшее развитие ДВС
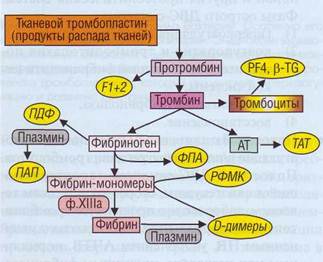
Рис. 148. Продукты гиперактивации плазменного гемостаза, которые не обнаруживаются в норме, но характерны для ДВС-синдрома. ПДФ - продукты деградации фибриногена/фибрина, ТАТ - тромбин-антитромбиновый комплекс, ПАП - комплекс плазмин-антиплазмин, ФПА - фиб-ринопептид А, РФМК - растворимые фибрин-мономерные комплексы, F1 + 2 - фрагменты протромбина, PF4 - фактор 4 тромбоцитов, P-TG - (3-тромбоглобулин
Лабораторные показатели, характеризующие состояние гиперкоагуляции
и фазы ДВС-синдрома
Таблица 65

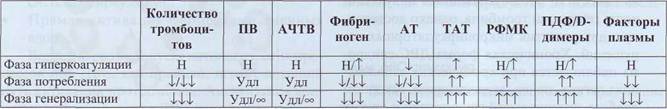
Удл - удлинение теста, Удл/°° - удлинение / тест не определяется в течение времени измерения.
Патология гемостаза
Однако все эти тесты могут проявляться не только в стадии гиперкоагуляции при ДВС-син-дроме, но и при тромбообразовании, при массивной тромболитической терапии. Например, при нестабильной стенокардии и остром инфаркте миокарда несколько маркеров активации гемостаза, как правило, дают положительную информацию. Это тесты на фибринопептид А (ФПА), комплекс тромбин-антитромбин (ТАТ), продукты паракоагуляции, D-димеры. При врожденной
тромбофилии из-за дефицита протеина С или S примерно у 1/4 пациентов выявляют увеличение ТАТ или других маркеров активации гемостаза даже без каких-либо признаков острых тромбозов. В то же время часто при наличии тромбов не определяются маркеры тромбообразования. Поэтому лабораторные тесты, даже в совокупности, играют вспомогательную роль в постановке диагноза ДВС-синдром.
Клинический пример 17
Больная 59 лет. Острый промиелоцитарный лейкоз. ДВС (?).
В области верхних, нижних конечностей гематомы.
Коагулологическое обследование: НЬ 118 г/л, тромбоциты - единичные, АЧТВ 65 с (норма 35-45 с), ПИ 49%, ТВ >60 с, фибриноген 0,7 г/л, лизис эуглобулиновой фракции 75 мин (норма
140-240 мин), ПДФ (латекс-тест) 10-40 мг/мл (норма - отр.), агрегация тромбоцитов с АДФ отсутствует.
Заключение: на фоне резкой гипофибриноге-немии отмечается значительное замедление про-тромбиназообразования по внешнему и внутреннему путям. Активация фибринолиза. Агрегация на фоне выраженной тромбоцитопении отсутствует.
Диагностика ДВС-синдрома
Диагностика острого ДВС-синдрома начинается с оценки клинической ситуации. При подозрении на возможность развития острого ДВС рекомендуется срочно исследовать число тромбоцитов и содержание фибриногена, что позволит избежать ошибочных выводов, так как часто при патологических состояниях, приводящих к развитию острого ДВС, уровень тромбоцитов и фибриногена может быть повышен. В этих случаях снижение числа тромбоцитов и уровня фибриногена до нормальных величин является серьезным основанием для подозрения на начало ДВС. В этом случае рационально, кроме числа тромбоцитов и концентрации фибриногена, провести общие скрининговые тесты - ПВ, АЧТВ и ТВ, а также исследовать активность естественных антикоагулянтов, прежде всего антитромбина. Однако при трактовке общих скрининговых тестов следует помнить, что на показатели ПВ и АЧТВ в значительной степени влияет тромбин. Последний в избытке имеется в плазме больных с острым ДВС и может стать причиной нормальных результатов даже на фоне значительного снижения прокоагулянтов. Поэтому для подтверждения диагноза ДВС рекомендуется провести специаль-
ные тесты на повышенное образование тромбина и плазмина.
Диагностика хронического ДВС-синдрома требует тщательной оценки клинических и лабораторных данных. Для хронического ДВС-синдрома характерно повышение маркеров тромби-немии, в том числе D-димеров.
Основные тесты, указывающие на активацию свертывающей системы, - это тесты, выявляемые иммунохимическими методами. Моноклональ-ные антитела, используемые в этих тестах, позволяют идентифицировать состояние факторов как «активное» или «неактивное» или как «заблокированное ингибиторами», что бывает очень важным с точки зрения диагностики. Методы ELISA, иммунофлуоресценции или турбидиметрии и нефелометрии существенно расширяют возможности клинико-диагностической лаборатории в комплексной оценке и выявлении механизмов активации системы гемостаза. Ручные методы латекс-агглютинации также достаточно широко используются в диагностике механизмов нарушения гемостаза, но они постепенно заменяются автоматизированными методами иммунохимии. Все более активно в клинику внедряются экспресс-тесты прикроватной диагностики (D-диме-
Патология гемостаза
ры, фибринопептиды, ТАТ), основанные на принципе иммуно диффузии.
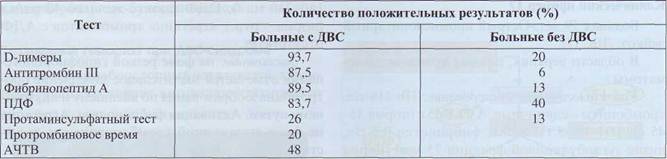
Определение D-димеров имеет высокую диагностическую чувствительность, но относительно низкую специфичность для ДВС-синдрома (табл. 66). Высокая чувствительность - показатель наибольшей надежности; использование этого теста гарантирует выявление ДВС. Низкая специ-
фичность обусловлена ложноположительными результатами, объясняется это тем, что данный тест фактически выявляет продукты деградации поперечно-сшитого фибрина, который составляет основу любых тромбов и не зависит от причины их образования. Поэтому этот тест выявляет лизис нерастворимого фибрина, а реактивный фибри-нолиз - практически обязательный элемент ДВС.
Таблица 66
Сравнительная характеристика специфичности и чувствительности диагностики ДВС-синдрома
|
Локализованное внутрисосулистое свертывание крови (ЛВС)

ЛВС - патологическое состояние, связанное с потреблением факторов свертывания крови, происходящим в строго анатомически ограниченном участке, как правило, в области сосудистых аномалий.
Лабораторные изменения при ЛВС характеризуются тромбоцитопенией, гипофибриногене-мией, повышением количества продуктов деградации фибриногена/фибрина или D-димеров. Состояние почти никогда не связано с окклюзией микроциркуляторного русла и ишемией органов.
Основные патологические состояния, которые приводят к ЛВС:
1. Аневризма аорты. Синдром потребления при
аневризме аорты может быть значительно
выражен и приводить к развитию геморраги
ческих проявлений.
2. Гемангиомы. Выраженность синдрома по
требления часто зависит от размеров опухо
ли. Геморрагический синдром в этих случаях
связан не только с коагулопатией и тромбо
цитопенией, но и с повышенной кровоточи
востью из измененных сосудов.
3. При некоторых заболеваниях почек, особен
но при возникновении реакции отторжения
аллогенного почечного трансплантата, возникает процесс потребления фибриногена, при котором лабораторно находят повышение продуктов деградации фибриногена/фибрина в моче, тогда как в крови эти показатели повышены незначительно или нормальные.
Сахарный диабет
Микро- и макроангиопатии при сахарном диабете сопровождаются существенными повреждениями сосудистого эндотелия (рис. 149). При хронической гипергликемии гликопротеины сосудистого гликокаликса, тромбоцитов и других клеток крови подвергаются неферментативному гли-кированию, что сопровождается нарушением их функциональных свойств. Очевидно, с этим связано нарушение системной сосудистой проницаемости, потеря антиадгезивных свойств сосудистого эндотелия, усиление тромбообразования и, в результате, формирование микро- и макроангиопатии, сопровождающееся лабильностью всей системы гемостаза. У больных сахарным диабетом, особенно страдающих ретино- и нефропати-
Патология гемостаза
ями, должен проводиться контроль состояния со-судисто-тромбоцитарного гемостаза.
Повышенное артериальное давление и гемодинамическое напряжение сдвига
Повышенное артериальное давление и напряжение сдвига могут быть причиной повреждения сосудистой стенки и активного пристеночного тромбообразования. Турбулентные потоки крови в местах бифуркации, участках отхождения боковых артерий от аорты (рис. 150), выступающих в просвет атероматозных бляшек, наиболее уязвимы для развития атеротромбоза. При хроническом повышении системного давления риск патологического тромбообразования существенно возрастает.
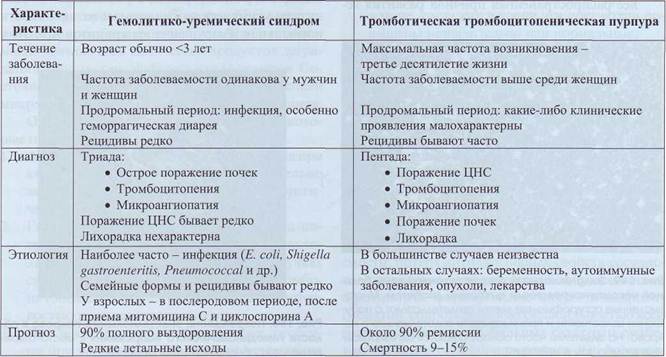
Тромботическая тромбоцитопеническая пурпура, гемолитико-уремический синдром
Тромботическая тромбоцитопеническая пурпура и гемолитико-уремический синдром -два близких заболевания, характеризующихся диффузной окклюзией артериол и капилляров, вызывающей ишемическую дисфункцию многих органов.
Этиология:
• Шигатоксин-продуцирующие Е. coli - наиболее распространенная причина развития ге-
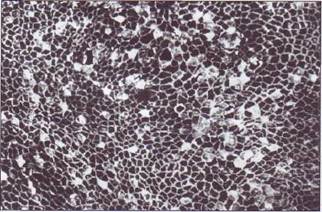
Рис. 149. Эндотелиальный покров пупочной вены больной некомпенсированным сахарным диабетом. Многочисленные аргирофильные клетки свидетельствуют о нарушении целостности и проницаемости эндотелиального покрова. На эндотелии часто обнаруживаются адгезирован-ные тромбоциты и лейкоциты
молитико-уремического синдрома у маленьких детей, однако может служить причиной тромботической тромбоцитопенической пурпуры и гемолитико-уремического синдрома в любом возрасте.
• Другие инфекции, в частности S. dysenterie
(тип I), Shigella.
• Лекарства, чаще всего хинин, митомицин С
и циклоспорины.
• Трансплантация костного мозга.
• Онкологические заболевания.
• Осложнения беременности и родов, особен
но преэклампсия.
• Аутоиммунные заболевания.
| Рис. 150. Повреждение эндотелиального покрова в области гемодинамического напряженияу места отхождения межреберных артерий от аорты |
Патогенез обоих заболеваний. В основе обоих заболеваний лежит, по-видимому, высвобождение сверхвысокомолекулярного фактора Вил-лебранда из депо вследствие поражения эндотелия и тромбоцитов. Фактор Виллебранда со сверхвысокой молекулярной массой связывается с тромбоцитами, активирует их, вызывает образование тромбоцитарных микросгустков и их отложение в микроциркуляторном русле с развитием ишемии и органной симптоматики. Различие в патогенезе этих двух заболеваний заключается в том, что у пациентов с тромботической тромбоцитопенической пурпурой снижена активность плазменных металлопротеаз, редуцирующих фактор Виллебранда, а у пациентов с гемо-литико-уремическим синдромом их активность нормальная. Разрушение эритроцитов при этих
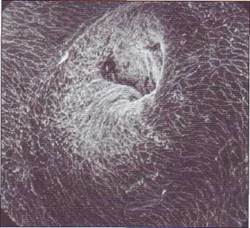
Патология гемостаза
состояниях является следствием повреждающего воздействия на них сил тока крови. На участках микроциркуляторного русла, частично обтуриро-ванных микротромбами, повышается интенсивность механического воздействия на клетки крови, что приводит к внутрисосудистому гемолизу. В табл. 67 даны сравнительные характеристики тромботической тромбоцитопенической пурпуры и гемолитико-уремического синдрома.
Помимо поражения почек и ЦНС, для пациентов с тромботической тромбоцитопенической пурпурой и гемолитико-уремическим синдромом характерны микроангиопатическая гемолитическая анемия, тромбоцитопения, нарушения со стороны желудочно-кишечного тракта (боль, диарея, тошнота, рвота).
Лабораторная картина. Исследование мазков крови выявляет нарастающую фрагментацию эритроцитов (в первые часы признаков фрагментации может не быть или она минимальна) и тромбоцитопению. При исследовании на гематологическом анализаторе характерно увеличение показателя RDW, уменьшение MCV и PLT. В биохимическом анализе крови - изменение непрямо-
го билирубина, повышение активности лактатде-гидрогеназы пропорционально интенсивности гемолиза.
Приобретенные нарушения гемостаза, ассоциированные с парапротеинемиями
Приобретенные нарушения гемостаза, ассоциированные с парапротеинемиями, возникают при множественной миеломе, макроглобулине-мии Вальденстрема, хроническом лимфолейко-зе, злокачественной лимфоме, моноклональных гаммапатиях, амилоидозе, реже при некоторых других заболеваниях.
Патогенез этих нарушений следующий. Вырабатываемые опухолями моноклональные иммуноглобулины связываются с тромбоцитами и белками. Фиксированные на тромбоцитах антитела приводят к тромбоцитопении, нарушению функции тромбоцитов или к их сочетанию. В том числе может возникать приобретенный синдром Виллебран-да. Клинически эти нарушения могут проявляться повышенной кровоточивостью по микроциркуля-торному типу, значительным удлинением тромби-
Таблица 67
Сравнительная характеристика тромботической тромбоцитопенической пурпуры
и гемолитико-уремического синдрома
|
Патология гемостаза
нового времени, однако геморрагических проявлений может и не быть. Влияние парапротеинов на коагуляционное звено гемостаза чаще выражается в нарушении полимеризации фибрина, кроме того,
описаны случаи ингибирования фактора VIII, других факторов свертывания крови, белков системы фибринолиза и возникновение лабораторного феномена волчаночного антикоагулянта.
Приобретенные нарушения гемостаза у новорожденных и детей первого полугода жизни
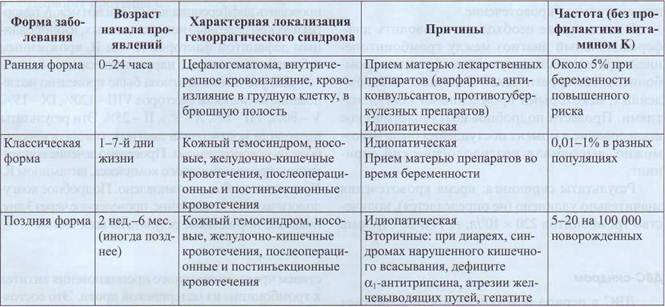
Геморрагическая болезнь новорожденных
Геморрагическая болезнь новорожденных возникает вследствие дефицита витамина К. Основное проявление геморрагической болезни - геморрагический синдром, преимущественно по гема-томному типу за счет значительного снижения ви-тамин-К-зависимых белков в плазме. В табл. 68 представлены классификация и характеристики геморрагической болезни новорожденных.
Диагностика геморрагической болезни новорожденных основана на наличии геморрагического синдрома и лабораторных данных о дефиците витамин-К-зависимых факторов свертывания крови. Дифференциальная диагностика геморрагических состояний в периоде новорожденности, основанная на скринин-говых лабораторных тестах, представлена в табл. 69.
Характеристика геморрагической болезни новорожденных
Таблица 68
|
Date: 2015-05-19; view: 781; Нарушение авторских прав