
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Решение уравнения Шрёдингера для молекулы водорода, для гомоядерных и гетероядерных двухатомных молекул. Молекулярные термы
Электронные состояния атомов нумеруют с помощью квантового числа L, задающего квадрат суммарного углового момента электронов. В отсутствии внешних полей все направления равноправны, и состояния с разными проекциями момента на ось z (напомним, что таких состояний ровно 2L+1) имеют одинаковую энергию. В результате энергетические уровни 2L+1-кратно вырождены. Обычно значения L задают буквами, как в атоме водорода, где состояния обозначаются как s, p, d… при значениях квантового числа l, описывающих угловой момент электрона, 0, 1, 2,... соответственно. Как принято в квантовой механике, для состояний многоэлектронных систем используются заглавные буквы: состояниям с L = 0, 1, 2,.. соответствуют символы S, P, D,…латинского алфавита.
Атом обладает очень высокой сферической симметрией и классификация состояний по угловому моменту – это классификация по типам симметрии относительно всевозможных поворотов. Кроме поворотов группа симметрии атома включает инверсию. При инверсии волновая функция может либо сохранять, либо менять знак, т.е. состояния обладают определенной четностью. Четность указывают не всегда, причем раньше её указывали нижними индексами g или u (от немецких слов gerade и ungerade), а потом стали использовать верхние индексы "o" (от английского слова odd) для указания только нечетных состояний. В верхнем левом углу символа состояния указывают спиновую мультиплетность – число 2S+1. Принято называть состояния с заданной мультиплетностью 2S+1 синглетными (S = 0, 2S+1 = 1), триплетными (S = 1, 2S+1 = 3), квинтетными (S = 1, 2S+1 = 3) и т.д. (при четном числе электронов в атоме и, следовательно, целом значении S) и дублетными (S = 1/2, 2S+1 = 2), квартетными (S = 3/2, 2S+1 = 4), секстетными (S = 5/2, 2S+1 = 6),...(при нечетном числе электронов). Состояние атома с данными L и S вырождено (2S+1)×(2L+1) раз.
Например, низшие по энергии состояния атома азота – это 4So, 2Do, 2Po, 4P, 2P,... Cимвол состояния 2Do, например, произносится так: "нечетное дублетное D-состояние". Это состояние имеет кратность вырождения 2×(2×2+1) = 10, а четное квартетное Р-состояние (4P) – 4×3 = 12.
При заметном спин-орбитальном взаимодействии имеет смысл лишь суммарный электронный момент J = L+S. Число J, нумерующее собственные значения квадрата суммарного момента указывают обычно справа внизу символа состояния. Такое состояние вырождено 2J+1 раз.Для тяжелых атомов иногда указывают только J (цифрой) и чётность состояния. Индексы i и r, используемые иногда в символах состояний, указывают на заполнение валентной оболочки больше, или меньше чем на половину. Одну и ту же конфигурацию, например, 1s2 2s2 2p2 имеют принципиально разные электронные состояния 3P0, 3P1, 3P2, 1D2, 1S0 (приведены в порядке возрастания энергии, определяемом иногда правилами Гунда) атома С. Электронные термы этих состояний составляют соответственно 0, 16.40, 43.40, 10192.63, 21648,01 см-1 (терм низшего по энергии, основного состояния по традиции принимается равным нулю). Напомним также, что задание волновой функции электронной конфигурацией имеет смысл лишь в контексте приближенных методов типа Хартри–Фока или функционала плотности.
Двухатомная молекула обладает довольно высокой симметрией. Два ядра лежат на оси z и задают аксиально-симметричный потенциал, в котором движутся электроны. Группа симметрии ядерной конфигурации включает операции поворотов вокруг осисимметрии С ∞ и отражения в любых плоскостях симметрии σv, содержащих эту ось. Такая группа симметрии – С ∞v – соответствует гетероядерным молекулам. В случае гомоядерных молекул имеется ещё центр инверсии i, а также другие элементы симметрии, вызванные наличием i: любые оси симметрии второго порядка, проходящие через центр и перпендикулярные оси z, а также плоскость симметрии σh, перпендикулярная оси z. Эти молекулыотносятся к группе симметрии D∞h. Осевая симметрия позволяет классифицировать электронные состояния с помощью оператора проекции суммарного электронного углового момента Lz. Собственные значения этого оператора задаются числами hLz (Lz =0, ±1,...) и, с классической точки зрения, описывают вращение электронов вокруг оси z. Поскольку вращению по- и против часовой стрелки должна отвечать одинаковая энергия, энергии состояний с одинаковыми значениями Λ=|Lz|, но разными знаками Lz, должны совпадать, т.е. эти состояния двукратно вырождены (если не принимается во внимание спин-орбитальное взаимодействие). Электронные состояния двухатомных молекул классифицируются по значениям квантовых чисел Λ и чисел, описывающих квадрат спина (S) и проекцию спина на ось z (Σ). При этом используют буквенные обозначения, похожие на обозначения состояний с разным угловым моментом для атомов. Если описывают симметрию волновых функций одноэлектронных состояний (т.е. орбиталей) с Λ = 0, 1, 2, 3,…, используют буквы греческого алфавита: σ, π, δ, ϕ… Для многоэлектронных систем используются заглавные буквы: Σ, Π, Δ, Φ...
Примечание: Соответствие s – σ, p – π, d – δ, f – Φ очевидно, но далее символы следуют в соответствии с греческим алфавитом: при Λ = 4, например, орбитали имеют тип ψ, а многоэлектронные функции – Ψ. В случае Σ-состояний возможно различие в волновых функции относительно отражения в плоскости σv: волновые функции состояний типа Σ+ не изменяются, а в случае состояний Σ– меняют знак на противоположный (для орбиталей в трехмерном пространстве эту четность не указывают, так как нельзя построить ненулевую орбиталь σ–типа). При Λ > 0 операции отражения σv соответствует уже рассмотренное изменение направления вращения. Для гомоядерных систем надо еще указать, меняет или не меняет знак функция при инверсии. Нечетные и четные функции обозначают нижними правыми индексами u или g соответственно. В верхнем левом углу символа состояния указывают спиновую мультиплетность – число 2S+1. Основное, самое нижнее по энергии электронное состояние обозначается буквой Х, следующие по энергии – заглавными буквами латинского алфавита А, В, С…, если состояния имеют ту же мультиплетность 2S+1, что и основное, или малыми буквами a, b, c,…, если они отличаются по спину; иногда используют штрихи при буквенных символах. Отметим, что в этой номенклатуре есть и исторически сложившиеся исключения. Дело в том, что нумерация электронных состояний "по имени" складывалась в том порядке, в котором эти состояния открывались (чаще всего в этих случаях используются символы состояния со штрихами).
Вырождение состояний с разными проекциями спина происходит, лишь, если в молекуле отсутствует или очень мало спин-орбитальное взаимодействие. Если оно велико, (что типично для молекул с тяжелыми ядрами), то электронное состояние молекулы характеризуется не только числом Λ, но и числом Ω, равным модулю проекции суммарного электронного момента импульса на ось: Ω=|Lz+Σ|. Например, для состояния типа 2Π возможные значения Ω могут быть равны 3/2 (при Lz =1, Σ = +1/2, или при Lz = –1, Σ = –1/2) и 1/2 (при Lz =1, Σ = –1/2 или при Lz = –1, Σ = +1/2). Такие состояния обозначают дополнительным символом Ω в правом нижнем углу (или в скобках).
Среднее значение электронного гамильтониана в электронном состоянии Ψn – это электронная энергия En. Она то и играет роль потенциальной энергии при изучении движений ядер с помощью ядерного уравнения Шредингера. Для двухатомной молекулы это уравнение можно записать так: (формула)
http://www.chem.msu.su/rus/teaching/kovba-pupyshev/kovba-pupyshev-spectra.pdf (стр.12) Здесь ψn,k – ядерная волновая функция, ε
n,k – энергетические уровни молекулы, а символы n и k использованы для указания состояний электронов (n) и состояний ядер (k).
Ядерное уравнение Шредингера описывает поведение двух ядер под действием потенциала En, зависящего лишь от взаимного расположения ядер в пространстве. Из курса физики известно, что подобные "задачи двух тел" можно решить, используя радиус-вектор центра масс и вектор относительного положения ядер: (формула)
В этом случае ядерный гамильтониан оказывается суммой двух гамильтонианов, один из которых – кинетическая энергия центра масс, зависящая лишь от координат центра масс. Этот оператор описывает свободное движение центра масс молекулы (соответствующая волновая функция – это, где k – волновой вектор, показывающий направление импульса центра масс, а энергия поступательного движения центра масс равна (формула). Второй гамильтониан зависит только от переменных
относительного движения R; информация о строении молекулы в основном содержится именно в этом гамильтониане. Поскольку переменные разделяются, функция стационарного состояний будет произведением волновых функций свободного движения центра масс и функции относительного движения частиц, зависящей лишь от R, так что, изучая переходы в молекуле, мы будем рассматривать только изменения этой функции. В классической модели это построение отвечает разбиению энергии молекулы на поступательную и внутреннюю.
После отделения переменных центра масс ядерное уравнение Шредингера (7.1) будет иметь вид: (формула) (7.2),
где R = Ra– Rb, μ – приведенная масса: (формула). В сферических координатах (R,θ,ϕ) оператор Гамильтона в ядерном уравнении запишется как: (формула)(7.3).
Первое слагаемое здесь отвечает кинетической энергии для радиальных (колебательных) движений, а второе имеет вид кинетической энергии вращения. μR2 – это момент инерции ядер относительно центра масс, а LR2 – зависящий лишь от полярных углов оператор квадрата углового момента ядер. Если использовать метод разделения переменных и представить волновую функцию ψ(R) в виде произведения функции χ(R), зависящей только от R, и функции Y(θ,ϕ), зависящей лишь от полярных углов (эти функции известны из квантовой механики как сферические гармоники), то нетрудно выписать уравнение для функции χ(R).
К сожалению, в таком понятном рассуждении есть существенный недостаток. В отсутствие внешних полей должен сохраняться полныймомент J всей молекулы как целого, а не только угловой момент ядер. Даже если не учитывать дающий очень малый вклад в энергию ядерный спин, то надо было бы полагать, что сохраняется не LR, а J = L + S + LR. Тем не менее, мы заменим оператор квадрата момента в ядерномуравнении на оператор J2 (например, ссылаясь на то, что массы ядер намного больше, чем у электронов, а электроны улетают от ядер не слишком далеко. Кроме того, если проделать весьма громоздкие выкладки, приводимое ниже уравнение для радиальной функции тоже получится, но со слегка модифицированным потенциалом). Поскольку момент сохраняется, все состояния молекулы можно классифицировать по собственным значениям оператора квадрата полного момента J2, а они равны. Тогда ядерное уравнение (7.1), будет зависеть только от радиальной координаты (такое ядерное уравнение часто называют радиальным уравнением) и запишется, как: (формула) (7.4).
Энергия молекулы εn,J,v определяется номером электронного состояния n, вращательным квантовым числом J и номером колебательного состояния v. Напомним, что одним и тем же квадратом момента обладают 2J+1 состояний, различающихся проекцией Jz момента на ось z системы координат. Все эти состояния имеют одну и ту же энергию, то есть вырождены. Разумеется, разным значениям Jz соответствуют разные функции YJ,Jz , зависящие от угловых переменных и описывающие вращение молекулы. Радиальная функция отвечает условию нормировки (формула) (множитель R 2 возник здесь из-за перехода к сферическим координатам). Поскольку в
таком виде уравнение (7.4) для радиального движения выглядит несколько громоздко, его можно упростить, положив (фомула). Очевидно, условие нормировки для функции u(R) – это обычное условие (формула) =1, а уравнение для неё выглядит как уравнение Шредингера для одной частицы массы μ: (формула) (7.5)
Это уравнение мы будем использовать для описания колебательно-вращательных движений молекулы. Волновую функцию молекулы можно приближенно представить произведением нескольких функций:
а) электронной волновой функции Фn(r,R), получаемой из электронного уравнения Шредингера (4.1),зависящей от радиус-векторов электронов rj
и их спиновых переменных, а также, как от параметров, от радиус-векторов всех ядер R,
б) волновой функции свободного движения центра масс молекулы - e±i(k,Rcm),
в) вращательной части волновой функции YJ,Jz , зависящей лишь от угловых переменных, описывающих поворот молекулы как целого,
г) колебательной волновой функции un,J,v(R), удовлетворяюшей уравнению (7.5).
При сделанных приближениях энергия молекулы – это сумма энергии свободного движения центра масс (поступательной энергии) и электронно-колебательно-вращательной энергии εn,J,v.
Электронно-колебательно-вращательную энергию молекулы можно получить, решая уравнение (7.5). На рисунках 2, 3 приведены результаты численного решения такойзадачи. (Следует отметить, что, решая ур.(7.5) мы определим не только электронно-колебательно-вращательную энергию, но и колебательную волновую функцию un,J,v(R), соответствующую этому энергетическому состоянию молекулы.) Для решения уравнения (7.5) необходимо знать функцию En(R) (электронную энергию или потенциал ядерного уравнения), являющуюся решением электронного уравнения Шредингера (4.1). Она может быть задана просто поточечно, однако очень часто потенциал En(R) аппроксимируют подходящей аналитической функцией. Вблизи точки минимума (R = Re) электронную энергию можно разложить в ряд, первые члены которого в квадратичном приближении будут иметь вид En(R) ≈ En(Re) + kn(R–Re)2/2, где kne – вторая производная потенциала в точке Re: (формула). При J = 0 уравнение (7.5) с таким потенциалом нетрудно решить, так как это просто задача о
гармоническом осцилляторе: (формула) (8.1)
Значения энергии в такой задаче определяется как: (формула); где
(Формула)– классическая частота колебаний тела массы μ на пружине с силовой постоянной ke, v – номер колебательного уровня, En - электронная энергия данного электронного состояни при равновесном межъядерном расстоянии (Re). Волновые функции un,v(R–Re) выражаются как произведение полинома Эрмита и функции вида
exp(–β(R–Re)2) с некоторым коэффициентом β, т.е. быстро спадают при удалении от точки R = Re. Если вернуться к первоначальной задаче с потенциалом En(R), то с помощью сделанной оценки в гармоническом приближении можно методами теории возмущений вычислить значение энергии колебательного уровня с номером v более точно. При этом оказывается, что поправка к энергии оценивается рядом по степеням величины (v+1/2). В итоге получается ряд, обозначения и выбор знаков коэффициентов (колебательных постоянных) которого – спектроскопическая традиция: (формула) (8.2)
Величина ћωexe(v+1/2)2 называется поправкой на ангармоничность, а коэффициент ωe xe – коэффициентом ангармоничности. Отметим, чтосогласно уравнению. (8.2) с ростом колебательного квантового числа vрасстояние между соседними уровнями энергии становится все меньше и меньше, тогда как в простом гармоническом приближении расстояние между колебательными уровнями остается величиной постоянной. Для аппроксимации функции En(R) часто используют потенциала Морзе:(формула). Точное решение ур.(7.5) с таким потенциалом соответствует выражению (8.2), если оборвать ряд на квадратичном по (v+1/2) слагаемом: (формула) (8.3)
Тогда можно найти и явные выражения для гармонической частоты ωe и коэффициента ангармоничности ωexe через параметры потенциала α и D: (формулы). В этом случае расстояние между колебательными уровнями энергии линейно зависит от v: εnv+1 – εnv = ћωe – 2ћωexe(v+1/2). По выполнению такого линейного соотношения часто судят о применимости модели Морзе. Отметим, что число колебательных состояний для потенциала Морзе конечно (в отличие от гармонического потенциала) – максимально возможное значение v можно найти из условия εnv+1 – εnv ≥ 0, т.е. v≤ωe/(2ωexe)–1/2.
Поведение радиальных функций un,0,v(R) колебательных движений ядер (при J = 0) можно понять из рисунка 2. Как видно из рисунка, при малых значениях колебательного квантового числа v волновые функции очень похожи на волновые функции гармонического осциллятора. Для R, отвечающих области, в которой двигалась бы классическая частица, т.е. между точками, в которых энергия частицы равна потенциалу (их называют "точками поворота"), функции осциллируют. В классически запрещенных областях (где потенциал больше энергии) функции быстро спадают. Важно отметить, что даже при относительно небольших v колебательные волновые функции заметно отличны от нуля возле точек поворота. Это можно объяснить тем, что (по классическим представлениям) наиболее велика вероятность найти частицу в тех областях, где скорость её мала, то есть именно в окрестностях точек поворота. Описанное явление лучше видно на рисунке 3, изображающем распределение ядерной плотности в той же системе.
(2 жопных не копирующихся рисунка)
Заметив, что волновые функции гармонического осциллятора локализованы возле равновесного расстояния, мы можем применить теорию возмущений и для учета энергии вращения. Применение теории возмущений даст поправки к энергии в виде ряда по степеням J(J+1). Например, в первом порядке теории возмущений надо просто рассмотреть среднее значение оператора (формула) на функциях unv(R–Re) гармонического осциллятора. Разложив оцениваемый потенциал в ряд по степеням (R–Re), находим, что при некоторых коэффициентах с 2, с3,. поправка к энергии имеет вид:
(формула) где Bv, Dv, Hv … являются рядами по степеням (v+1/2).
Выписанное выражение для энергии позволяет, как и в классической модели
молекулы, представить внутреннюю энергию как сумму электронной (Eеn), колебательной и вращательной энергии: E = Ee + Evib +Erot. Состояние молекулы задается указанием электронного состояния (n; обычно указывается символ электронного состояния, например, 2П), колебательным (v) и вращательным (J) квантовыми числами. В самом грубом приближении (жесткий ротатор) можно пренебречь зависимостью Bv от v и вообще не рассматривать остальные вклады во вращательную энергию.
Понятие "электронная конфигурация". Метод многоконфигурационного самосогласованного поля (МК ССП). Метод конфигурационного взаимодействия (КВ). Одноконфигурационное приближение: метод Хартри-Фока. Понятие "электронная корреляция". Ферми-корреляция и кулоновская корреляция.
Электронная конфигурация — формула расположения электронов по различным электронным оболочкам атома химического элемента или молекулы.
Метод многоконфигурационного взаимодействия (Multi-Configurational Self-Consistent Field – MCSCF) можно рассматривать как метод КВ, в котором оптимизируются не только коэффициенты перед детерминантами, но и коэффициенты разложения МО по АО.
Метод конфигурационного взаимодействия основан на вариационном принципе, аналогично методу Хартри – Фока. Пробная функция записывается в виде линейной комбинации детерминантов, и коэффициенты определяются из условия минимума энергии. Детерминанты классифицируют на однократно (s), дважды (d), трижды (t) и т.д. возбужденные, и функция конфигурационного взаимодействия приобретает следующий вид:
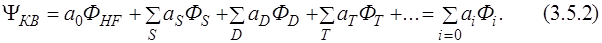
Применяя вариационный принцип, получаем набор секулярных уравнений:
(H - E I) a = 0; (3.5.3)
или:
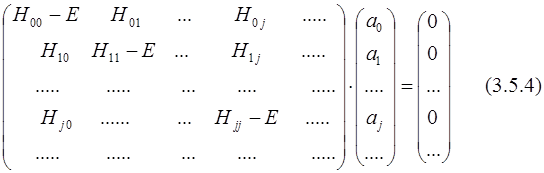
Здесь H – матрица конфигурационного взаимодействия (КВ),
I – единичная матрица.
Матричный элемент матрицы КВ вычисляется из детерминантов: 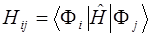 . Если два детерминанта отличаются друг от друга более чем двумя пространственными молекулярными орбиталями (МО), то всегда будет существовать интеграл перекрывания между двумя разными МО, который равен нулю. Элементы матрицы КВ могут быть, следовательно, отличны от нуля, если два детерминанта одинаковы или отличаются одной или двумя МО, и они могут быть выражены через интегралы одно- и двухэлектронных операторов и МО. Эти соотношения известны как правила Слэйтера – Кондона. Согласно теореме Бриллюена, матричные элементы между детерминантом Хартри – Фока и однократно возбуждёнными состояниями (детерминантами) равны нулю.
. Если два детерминанта отличаются друг от друга более чем двумя пространственными молекулярными орбиталями (МО), то всегда будет существовать интеграл перекрывания между двумя разными МО, который равен нулю. Элементы матрицы КВ могут быть, следовательно, отличны от нуля, если два детерминанта одинаковы или отличаются одной или двумя МО, и они могут быть выражены через интегралы одно- и двухэлектронных операторов и МО. Эти соотношения известны как правила Слэйтера – Кондона. Согласно теореме Бриллюена, матричные элементы между детерминантом Хартри – Фока и однократно возбуждёнными состояниями (детерминантами) равны нулю.
Для вычисления элементов матрицы КВ необходимы одно- (3.5.5) и двухэлектронные (3.5.6) интегралы между МО. Они могут быть выражены через соответствующие интегралы атомных орбиталей (АО) и коэффициенты МО:
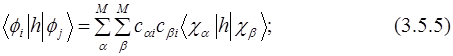
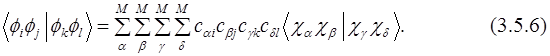
Эти интегралы необходимы для всех методов, учитывающих электронную корреляцию. Двухэлектронные интегралы атомных орбиталей 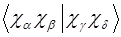 наиболее многочисленны, и соответственно время вычислений пропорционально 8-й степени размера базиса (
наиболее многочисленны, и соответственно время вычислений пропорционально 8-й степени размера базиса (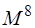 ). Однако если выполнять трансформацию одного индекса за раз, то время счёта можно сократить до
). Однако если выполнять трансформацию одного индекса за раз, то время счёта можно сократить до 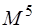 .
.
При численной реализации метода КВ сокращают число возбуждённых детерминантов. Включать только однократно возбуждённые детерминанты бессмысленно, так как все матричные элементы между ними и детерминантом Хартри-Фока равны нулю. Только дважды возбуждённые детерминанты дают отличные от нуля матричные элементы. Поэтому самым грубым приближением является включение в расчёт только двукратно возбуждённых детерминантов – модель CID (Configurational Interaction with Doubles). Включение однократно возбуждённых детерминантов даёт модель CISD (CI with Singles and Doubles). Хотя однократно возбуждённые детерминанты и дают нулевые матричные элементы с детерминантом Хартри-Фока, но они дают отличные от нуля матричные элементы с двукратно возбуждёнными детерминантами. Для больших базисов время счёта методом CISD пропорционально 6-й степени размера базиса (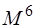 ).
).
Следующая ступень улучшения – включение трижды возбуждённых детерминантов – метод CISDT (время счёта пропорционально 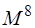 ). Для метода CISDTQ время счёта пропорционально
). Для метода CISDTQ время счёта пропорционально 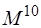 . Метод CISDTQ даёт результат, близкий к методу полного учёта КВ, но он применим только к небольшим молекулам. Единственный метод, широко применяемый для больших систем в настоящее время, – это CISDT. Он учитывает порядка 80-90% корреляционной энергии, хотя с увеличением размера молекулы процент учёта корреляционной энергии уменьшается
. Метод CISDTQ даёт результат, близкий к методу полного учёта КВ, но он применим только к небольшим молекулам. Единственный метод, широко применяемый для больших систем в настоящее время, – это CISDT. Он учитывает порядка 80-90% корреляционной энергии, хотя с увеличением размера молекулы процент учёта корреляционной энергии уменьшается
Метод Хартри – Фока даёт правильное решение на 99%, и логично его использовать за основу для дальнейшего улучшения. В общем мультидетерминантную функцию можно записать в следующем виде:

Здесь коэффициент а 0 обычно близок к единице; 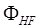 – детерминант Слэйтера, используемый в методе Хартри – Фока;
– детерминант Слэйтера, используемый в методе Хартри – Фока; 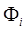 – возбуждённый детерминант Слэйтера, получаемый из
– возбуждённый детерминант Слэйтера, получаемый из 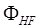 заменой одной или нескольких связывающих молекулярных орбиталей на виртуальные, что соответствует возбуждённой конфигурации.
заменой одной или нескольких связывающих молекулярных орбиталей на виртуальные, что соответствует возбуждённой конфигурации.
Недостатком метода Хартри – Фока является представление о движении электрона в усредненном поле всех остальных электронов. Но движение электронов является взаимозависимым – электроны стремятся расположиться как можно всегда дает завышенное значение общей энергии. Разность между энергией, вычисленной методом Хартри – Фока, и минимальной энергией, которую можно рассчитать в данном базисе, называется энергией электронной корреляции. дальше друг от друга вкаждый момент времени. В результате электроны в среднем располагаются несколько дальше друг от друга в сравнении с моделью усредненного поля Хартри, что снижает энергию их взаимодействия. Поэтому метод Хартри – Фока. Электронная корреляция – эффект, обусловленный мгновенным кулоновским отталкиванием между электронами (стремлением электронов «избежать друг друга»). Его учет приводит к более низкому значению полной энергии системы. Не учитывается в методе Хартри-Фока. Изменение энергии, вызванное этими мгновенными кулоновскими взаимодействиями, называется энергией корреляции: Eкорреляц. = Eточн. - EХФ < 0. Учет электронной корреляции особенно важен при исследовании эффектов, зависящих от возбужденных состояний или плохо описываемых в однодетерминантном приближении.
Корреляция электронов с разными спинами называется Кулоновской корреляцией. Под Кулоновской корреляцией понимают пониженную вероятность нахождения электрона с противоположным спином в районе заданного электрона. Пониженная вероятность нахождения электрона – Кулоновская дырка. Корреляция электронов с одинаковыми спинами называется Ферми корреляцией. Пониженная вероятность нахождения электрона с тем же спином возле данного электрона – Ферми дырка.
Метод Хартри-Фока. Понятие о самосогласованном поле. Орбитальные энергии. Одноэлектронные (остовные) интегралы. Двухэлектронные интегралы: кулоновские и обменные. Выражение для полной энергии в методе Хартри-Фока.
Волновая функция может быть найдена с помощью вариационного принципа при решении системы уравнений (3.1.16). Но вычисление матричных элементов оператора Гамильтона Hij становится проблематичным, если в системе присутствует не менее двух электронов.
Рассмотрим оператор Гамильтона для молекулы. Межъядерное отталкивание не зависит от координат электронов (в приближении Борна-Оппенгеймера) и является константой для заданной геометрии ядер. Притяжение электронов к ядрам представляет собой сумму вкладов, каждый из которых зависит от координат только одного электрона. То же самое относится и к оператору кинетической энергии. Проблемой является взаимодействие электронов друг с другом, так как электрон-электронное отталкивание зависит от координат двух электронов. Составные части оператора Гамильтона в атомных единицах можно выразить следующим образом для N электронов и M ядер:
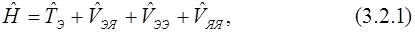
где
 – оператор кинетической энергии электронов,
– оператор кинетической энергии электронов,
 – оператор потенциальной энергии притяжения электронов к ядрам (
– оператор потенциальной энергии притяжения электронов к ядрам ( – заряд а -того ядра),
– заряд а -того ядра),
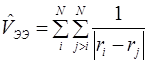 – оператор потенциальной энергии электрон-электронного отталкивания,
– оператор потенциальной энергии электрон-электронного отталкивания,
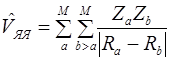 – оператор потенциальной энергии межъядерного отталкивания.
– оператор потенциальной энергии межъядерного отталкивания.
Далее можно выделить три типа операторов: операторы, зависимые от координат только одного электрона (3.2.2), операторы, зависимые от координат двух электронов (3.2.3), и операторы, не зависимые от координат электронов (оператор межъядерного отталкивания 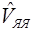 ):
):
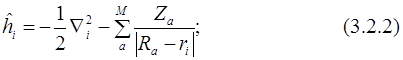

В результате оператор Гамильтона можно представить в следующем виде (3.2.4):
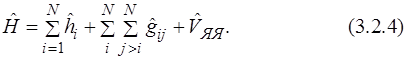
Одноэлектронный оператор  описывает движение i -того электрона в поле всех ядер. Оператор
описывает движение i -того электрона в поле всех ядер. Оператор 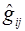 является двухэлектронным оператором, описывающим электрон-электронное отталкивание. Этот оператор зависит от координат двух электронов, что исключает возможность точного расчета матричного элемента оператора Гамильтона. Поэтому для систем с двумя и более электронами используются только приближенные методы, которые включают определенные допущения и имеют некоторые ограничения.
является двухэлектронным оператором, описывающим электрон-электронное отталкивание. Этот оператор зависит от координат двух электронов, что исключает возможность точного расчета матричного элемента оператора Гамильтона. Поэтому для систем с двумя и более электронами используются только приближенные методы, которые включают определенные допущения и имеют некоторые ограничения.
Впервые метод вычисления матричных элементов оператора Гамильтона и последующего решения уравнения Шрёдингера для систем с несколькими электронами был предложен Дугласом Хартри в 1927 г. Для простоты рассмотрим многоэлектронный атом с зарядом ядра Z и количеством электронов n. Оператор Гамильтона можно записать в следующем виде ( ):
):
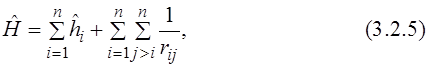
где
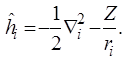
Проблема заключается в последнем слагаемом уравнения (3.2.5), являющемся оператором энергии межэлектронного отталкивания 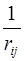 . Идея метода Хартри заключается в том, что взаимодействие каждого электрона в атоме с каждым из всех остальных заменяется взаимодействием электрона с усреднённым полем, создаваемым остальными электронами. Это позволяет заменить потенциал
. Идея метода Хартри заключается в том, что взаимодействие каждого электрона в атоме с каждым из всех остальных заменяется взаимодействием электрона с усреднённым полем, создаваемым остальными электронами. Это позволяет заменить потенциал 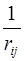 , зависящий от координат двух электронов, на функцию координат одного электрона. Поэтому это приближение называется также одноэлектронным.
, зависящий от координат двух электронов, на функцию координат одного электрона. Поэтому это приближение называется также одноэлектронным.
Хартри предложил искать волновую функцию системы, содержащей n электронов, в виде произведения одноэлектронных функций, что в конечном итоге и позволило "разделить" координаты электронов:
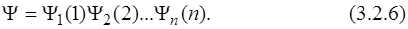
Каждая одноэлектронная функция зависит от координат только одного электрона, и для простоты в уравнении (3.2.6) в качестве аргумента функции указан номер электрона. Будем считать одноэлектронные функции ортонормированными, т.е.  . Тогда выражение для энергии принимает следующий вид (в соответствии с 5-м постулатом):
. Тогда выражение для энергии принимает следующий вид (в соответствии с 5-м постулатом):

Подставим в уравнение (3.2.7) оператор Гамильтона (3.2.4):
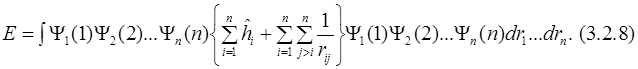
Выносим знак суммы перед знаком интеграла и разделяем выражение на две части:

Так как функции ортонормированы, а i -тый оператор действует только на i -тую функцию, то получим:
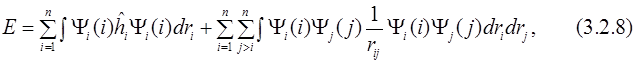
или

где

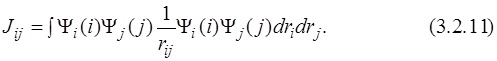
Если в выражении для энергии (3.2.9) проводить суммирование по всем j, не равным i, то перед двойной суммой возникает коэффициент 1/2, так как суммируются обе недиагональные части матрицы J:

В выражении для энергии Hi называется остовным интегралом и представляет собой сумму кинетической энергии электрона на орбитали Ψ i и потенциальной энергии его притяжения к ядру.
Интеграл Jij называется кулоновским и представляет собой среднюю энергию электростатического отталкивания электронов, находящихся на орбиталях Ψ i и Ψ j. При этом мы вводим ещё одно приближение: мы пренебрегаем всеми типами взаимодействий, кроме электростатического.
Неизвестные функции Ψ i находятся методом Лагранжа путём построения функционала, где εi – множители Лагранжа:
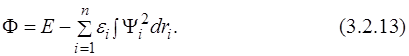
Функции находятся из равенства нулю первой вариации (3.2.14), что является условием экстремальности функционала (3.2.13):

Подставляем выражение для энергии (3.2.8) в (3.2.14) и получаем:
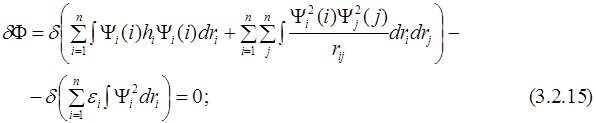
или:

Выражение равно нулю для любых вариаций  только тогда, когда коэффициенты при этих вариациях равны нулю, т.е.
только тогда, когда коэффициенты при этих вариациях равны нулю, т.е.
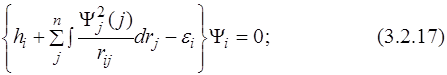
или:
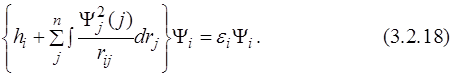
Последние уравнения (3.2.18) были впервые получены Дугласом Хартри и названы его именем. Эти уравнения называются одноэлектронными. Из вида уравнений (3.2.18) следует, что множители Лагранжа εi описывают энергию электрона на i -той орбитали с гамильтонианом Хартри. Этот оператор отличается от точного оператора Гамильтона заменой электростатического взаимодействия электронов (3.2.20) эффективным потенциалом (3.2.19):
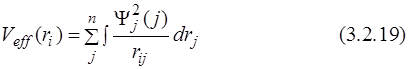
вместо

Эффективный потенциал (3.2.19) представляет собой усреднённое электростатическое взаимодействие i -того электрона со всеми остальными электронами. Поэтому суммирование нужно проводить по всем j ≠ i.
Чтобы получить выражение для орбитальных энергий, нужно умножить уравнения Хартри слева на Ψ i и проинтегрировать, что дает (3.2.21):

Сумма орбитальных энергий равна:

Из сравнения выражения (3.2.22) с выражением для полной энергии (3.2.12) получим соотношение между суммой орбитальных энергий и полной энергией системы:
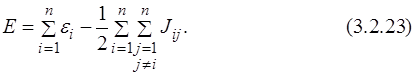
Каждое из уравнений Хартри зависит от координат только одного электрона. Но чтобы составить эти уравнения, нужно знать эффективный потенциал, который зависит от искомых функций Ψ j. Устранить это противоречие можно только при использовании метода последовательных приближений – путём итераций. В качестве начальных волновых функций берут какие-либо пробные функции Ψ j (0), например функции водородоподобного атома. С исходным набором функций рассчитывают óстовный и кулоновский интегралы, а затем решаются уравнения для каждого значения i. Другими словами, решается задача на собственные значения и собственные вектора оператора Хартри, который приближённо считается равным оператору Гамильтона.
Найденные функции 1-го приближения Ψ j (1) используются вновь для расчёта óстовного и кулоновского интегралов, и процедура повторяется – вычисляют функции Ψ j (2), Ψ j (3), … и соответствующие им энергии E(2), E(3), …. Повторение вычислений проводят до тех пор, пока для функций Ψ j ( n ) и Ψ j ( n +1) величины эффективных потенциалов (и соответствующие им энергии E( n ) и E( n +1)) не будут совпадать с заданной точностью. Это требование обусловливает название метода самосогласованного поля (ССП, SCF – Self-Consistent Field).
Недостатком метода Хартри является неправильный вид общей волновой функции, представленной в виде произведения одноэлектронных функций (3.2.6). Электроны являются фермионами – частицами с полуцелым спином, и, в соответствии с принципом Паули, система из нескольких электронов должна описываться антисимметричной волновой функцией. Это значит, что при перестановке двух электронов функция должна менять знак на противоположный: 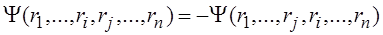 .
.
Поэтому Владимир Александрович Фок* усовершенствовал метод Хартри, предложив антисимметричную общую волновую функцию в виде определителя Слэйтера, составленного из ортонормированных (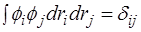 ) одноэлектронных функций:
) одноэлектронных функций:
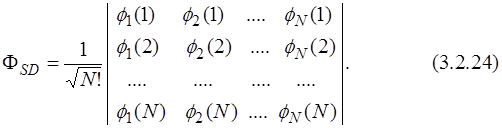
Date: 2015-05-19; view: 1844; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |