
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Лабораторная работа №4. 20. Исследование видимого спектра излучения атома водорода
|
|
Цель работы: Целью работы является исследование дифракционного спектра серии Бальмера в видимой области излучения и определение постоянных Ридберга и Планка.
Основные понятия и закономерности
Наиболее заметный вклад в развитие теории строения атомов внес Нильс Бор, однако теория Бора, основанная на известных постулатах, смогла объяснить только строение атома водорода и неприменима для объяснения свойств многоэлектронных атомов. Более универсальная и точная теория строения атомов основана на законах квантовой механики. Основным уравнением квантовой механики является уравнение Шредингера, которое по виду сходно с волновым уравнением, представляет собой дифференциальное уравнение второго порядка в частных производных описывает движение частицы массой m в пространстве с известным распределением потенциальной энергии:
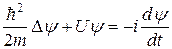 , (7.2)
, (7.2)
где 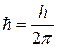 ,
,
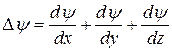 - оператор Лапласа,
- оператор Лапласа,
ψ – волновая функция,
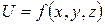 - потенциальная функция, описывающая распределение потенциальной энергии,
- потенциальная функция, описывающая распределение потенциальной энергии,
 - мнимая единица,
- мнимая единица,
m – масса микрочастицы.
Из теории дифференциальных уравнений известно, что каждое линейное уравнение в частных производных имеет множество решений. В применении к уравнению (7.2) это означает, что квантовая частица в потенциальном поле может находиться во многих состояниях. Такие состояния определяются начальными и граничными условиями. Среди решений уравнения Шредингера есть стационарные. В каждом стационарном состоянии средние значения всех физических величин не зависят от времени. В частности, для атома водорода потенциальная функция зависит только от координаты r и рассчитывается как потенциальная энергия электрона, находящегося в электрическом поле точечного заряда, сосредоточенного в ядре атома. Волновая функция любого стационарного электрона имеет вид:
 , (7.3)
, (7.3)
где  - зависит только от координаты r.
- зависит только от координаты r.
Состояние стационарно, так как равен единице модуль величины  . Поэтому плотность распределения координат частицы от времени не зависит:
. Поэтому плотность распределения координат частицы от времени не зависит:
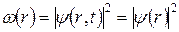 , (7.4)
, (7.4)
Величина  также называется волновой функцией, являясь ее координатной частью. Подставляя (7.3) в (7.2) и учитывая, что:
также называется волновой функцией, являясь ее координатной частью. Подставляя (7.3) в (7.2) и учитывая, что:
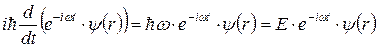 , (7.5)
, (7.5)
где 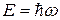 - полная энергия электрона.
- полная энергия электрона.
После сокращения на экспоненту правой и левой частей уравнения (7.5) приходим к стационарному уравнению Шредингера:
 , (7.6)
, (7.6)
или:
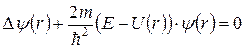 . (7.7)
. (7.7)
Здесь функция  описывает только стационарные состояния электрона с энергией E. Нахождение волновых функций
описывает только стационарные состояния электрона с энергией E. Нахождение волновых функций  является довольно сложной математической задачей из теории дифференциальных уравнений в частных производных. Ограничимся тем, что приведем результат решения и поясним его физический смысл.
является довольно сложной математической задачей из теории дифференциальных уравнений в частных производных. Ограничимся тем, что приведем результат решения и поясним его физический смысл.
Решения уравнения (7.7) существуют лишь при определенных значениях E, называемых собственными значениями энергии электрона:
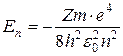 (7.8)
(7.8)
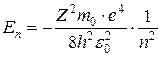 (7.9)
(7.9)
 где m и e – масса и заряд электрона,
где m и e – масса и заряд электрона,
m = 9,1·10-31 кг,
e = 1,6·10-19 Кл,
ε0 = 8,85·10-12 ф/м – электрическая постоянная,
h = 6,62·10-34 Дж·с, - постоянная Планка,
Заметим, что аналогичные выражения были получены для полной энергии атома водорода на основе постулатов Бора, которые определяют энергию атома в стационарном состоянии.
Для атома водорода Z = 1. Следовательно, энергия электрона на первой боровской орбите n = 1 равна:
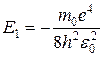 . (7.10)
. (7.10)
Полная энергия электрона в атоме водорода на орбите с номером n определяется формулой:
 . (7.11)
. (7.11)
Для водородоподобного иона, в составе которого всего один электрон, а заряд ядра Ze, энергия электрона равна:
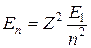 . (7.12)
. (7.12)
Величина энергии электрона в атоме водорода на первом уровне энергии (орбите) вычисляется по формуле (7.10):
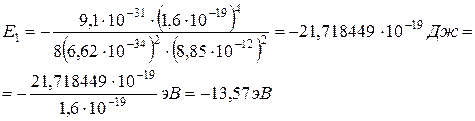
Используя правило частот Бора и найденное значение энергии электрона можно определить частоты, которые излучаются атомом при переходах из одного стационарного состояния в другое:
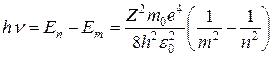 (7.13)
(7.13)
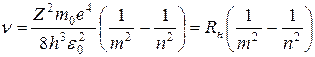 , (7.14)
, (7.14)
где  - постоянная Ридберга (7.15)
- постоянная Ридберга (7.15)
Для серии Бальмера m=2, величина n- квантовое число, которое для четырех линий видимого спектра водорода принимает значения 3,4,5 и 6.
Эксперимент по изучению видимой части спектра излучения атомарного водорода проводится с использованием газоразрядной водородной трубки.
Внутренний объем трубки составляет несколько кубических сантиметров, в этом объеме находится более миллиона атомов. При возникновении электрического разряда большая часть атомов переходит в возбужденное состояние. В возбужденном состоянии атомы находятся короткое время, называемое временем жизни возбужденного атома, а затем релаксируют, излучая избыточную энергию в виде квантов в соответствии со схемой, приведенной на рисунке 1. При этом интенсивность разных спектральных линий оказывается различной и определяется вероятностью того или иного перехода. Наиболее яркими являются линии, образованные переходами между ближайшими уровнями стационарных значений энергии. Такие линии называются головными в каждой серии. В серии Бальмера головной является линия Hα, соответствующая переходу атома из состояния с n=3 в состояние m=2. Кроме того вероятность переходов атома из одного состояния в другое зависит от орбитального квантового числа ℓ, определяющего момент количества движения электрона в атоме. Рассматривая атом водорода как замкнутую систему, необходимо учитывать не только неизменность полной энергии, но и сохранение суммарного момента импульса атома при любых внутренних превращениях, включая переходы из одного энергетического состояния в другое. При этом квант энергии или фотон, который излучается, имеет определенную поляризацию. В квантовой теории единственной направленной величиной является спин или момент количества движения фотона. Состоянию фотона с любой поляризацией соответствуют значения проекции спина Sz= +1 или Sz= -1 на направление его распространения Z.
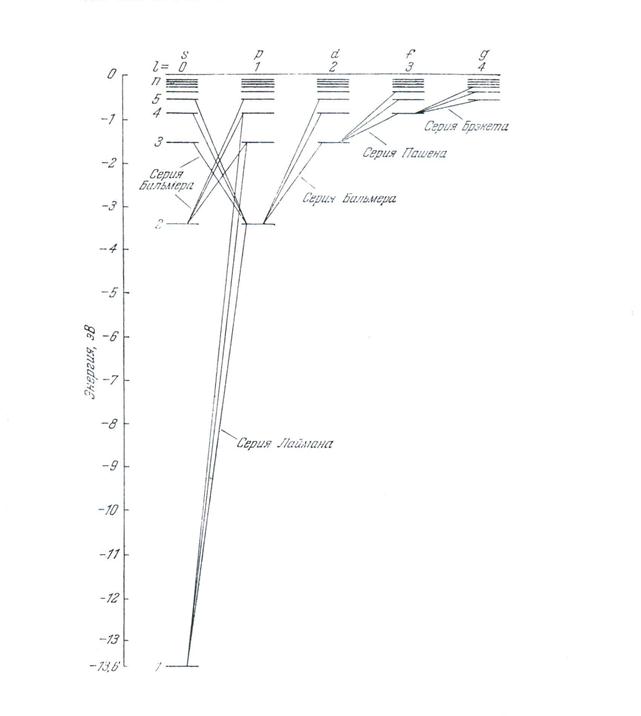 Таким образом, переходы атома водорода, сопровождающиеся излучением фотона, характеризуются изменением орбитального квантового числа атома на единицу. Это означает, что в квантовых переходах атомов с излучением света число ℓ может меняться только на единицу Δℓ=±1, а состояние атома с f на d, c d на p, с p на S и обратно.
Таким образом, переходы атома водорода, сопровождающиеся излучением фотона, характеризуются изменением орбитального квантового числа атома на единицу. Это означает, что в квантовых переходах атомов с излучением света число ℓ может меняться только на единицу Δℓ=±1, а состояние атома с f на d, c d на p, с p на S и обратно.
Этот и аналогичные результаты получили название правила отбора. Схема разрешенных кантовых переходов и соответствующие им спектральные линии представлена на рисунке 7.2.
Рисунок 7.2
Целью настоящей лабораторной работы является:
1) измерение длин волн линий в спектре водорода λ1, λ2, λ3, λ5;
2) вычисление значений постоянной Ридберга;
3) вычисление постоянной Планка с помощью каждого найденного значения длины волны и соответствующего ему значения числа n = 3,4,5,6.
Критерием справедливости сериальной закономерности служит постоянство значения постоянной Ридберга, найденного независимо во всех случаях. Измерение длин волн линий водородного спектра производится при помощи дифракционной решетки и гониометра. Углы φ, под которыми видны максимумы дифракционной решетки, зависит от длины волны измерения и удовлетворяют условию:
 , (7.16)
, (7.16)
где d – постоянная решетки,
к – порядок спектра испускания,(к=±1, ±2, …)
λ – длина волны,
φ – угол дифракции для данной длины волны.
Из формулы (60) имеем:
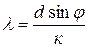 . (7.17)
. (7.17)
Частоты излучения:
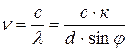 , (7.18)
, (7.18)
где с = 3·108 м/с – скорость света в вакууме (воздухе).
Из формулы (7.14) определяется постоянная Ридберга:
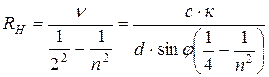 , (7.19)
, (7.19)
где n = 3,4,5 или 6, а к=±1, ±2, …
Из соотношения (7.15) вычисляется постоянная Планка:
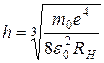 . (7.20)
. (7.20)
Date: 2015-05-18; view: 1066; Нарушение авторских прав