
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Теоретические сведения. Спектр излучения является важной характеристикой вещества, которое позволяет установить некоторые особенности его строения
|
|
Спектр излучения является важной характеристикой вещества, которое позволяет установить некоторые особенности его строения, свойства атомов и молекул. Спектры испускания и поглощения разных химических элементов состоят из множества линий, группы которых называются спектральными сериями. Наиболее простой спектр имеет атом водорода. Длины волн излучения описываются формулой Бальмера-Ритца:
 , (5.1)
, (5.1)
где λ – длина волны излучения,
R – постоянная Ридберга,
n1 и n2 – целые числа, соответствующие номеру стационарного состояния атома.
Каждой серии спектра атома водорода соответствует определенное значение n1 . n2 может принимать значения от n1 +1 до +∞.
Таким образом спектр излучения водорода можно представить в виде следующих серий (рисунок 5.1).
Серия Лаймана (n1 =1) – ультрафиолетовая область спектра.
Серия Бальмера ((n1 =2) – видимая область спектра и ближняя часть ультрафиолетовой области.
Серия Пашена (n1 =3) – инфракрасная область спектра.
 Серия Брэкета (n1 =4) - инфракрасная область спектра.
Серия Брэкета (n1 =4) - инфракрасная область спектра.
Серия Пфундта (n1 =5) - инфракрасная область спектра.
Рисунок 5.1
Линия, соответствующая переходу электрона в атоме водорода с уровня n=3 на уровень n=2 в серии Бальмера является наиболее яркой и называется головной линией (первая линия каждой серии – головная).
В данной работе определяются длины волн четырех линий серии Бальмера, принадлежащих видимой области спектра. Эти линии имеют следующие обозначения:
Hα – красная линия (n2 =3),
Hβ –голубая линия (n2 =4),
Hγ – сине-голубая (n2 =5),
Hδ – фиолетовая (n2 =6).
Как известно, экспериментальные исследования спектров излучения атомов послужили основой для построения теории, объясняющей их строение и закономерности в спектрах излучения и поглощения. Попытки построить модель атома, которая смогла бы объяснить возникновение спектров испускания, были предприняты Томсоном (1903 г.), Резерфордом (1913 г.) и потерпели неудачу.
Первая попытка построения неклассической теории атома была предпринята Н.Бором в 1913 г. В основе этой теории лежала идея связать в единое целое эмпирические закономерности линейчатых спектров (формулу Бальмера), ядерную модель Резерфорда и квантовый характер излучения света (теория Планка). В теории Бора не содержалось принципиального отказа от описания поведения электрона в атоме при помощи законов классической физики. Однако Бору пришлось дополнить классическое описание состояния электрона в атоме некоторыми ограничениями. Эти ограничения были сформулированы в виде постулатов.
Первый постулат Бора (постулат стационарных состояний) заключается в следующем: из бесконечного множества электронных орбит, возможных с точки зрения классической механики, осуществляются только некоторые дискретные орбиты, удовлетворяющие определенным квантовым состояниям, энергии которых составляют дискретный ряд: W1 ,W2,W3,...Wn. В стационарном состоянии атом не излучает.
Второй постулат Бора (правила квантования орбит): в стационарном состоянии атома электрон движется только по таким орбитам, для которых момент импульса электрона удовлетворяет условию:
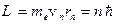 , (5.2)
, (5.2)
где ħ – постоянная Планка, равная 1,054.10-34 Дж.с;
n =1,2,3,…; me – масса электрона;
rn – радиус соответствующей орбиты.;
v n – скорость электрона.
Третий постулат Бора (правило частот): при переходе атома из одного стационарного состояния в другое испускается или поглощается один квант энергии.
Излучение происходит при переходе из состояния с большей энергией в состояние с меньшей энергией, т.е. при переходе электрона с орбиты, более удаленной от ядра, на более ближнюю к ядру:
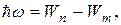 (5.3)
(5.3)
где 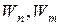 – энергия электрона на соответствующей орбите;
– энергия электрона на соответствующей орбите;
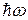 – квант энергии;
– квант энергии;

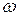 – циклическая частота излучения.
– циклическая частота излучения.
Теория Бора дала возможность построить модель атома водорода и водородоподобных ионов 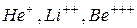 . Согласно этой теории атом состоит из ядра и электрона, движущегося по круговым стационарным орбитам. Электрон удерживается на круговой орбите кулоновской силой. Определим полную энергию электрона в водородоподобном атоме. Полная энергия электрона на орбите складывается из кинетической энергии электрона
. Согласно этой теории атом состоит из ядра и электрона, движущегося по круговым стационарным орбитам. Электрон удерживается на круговой орбите кулоновской силой. Определим полную энергию электрона в водородоподобном атоме. Полная энергия электрона на орбите складывается из кинетической энергии электрона 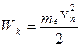 и потенциальной энергии взаимодействия электрона с ядром
и потенциальной энергии взаимодействия электрона с ядром 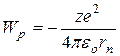 ,
,
где 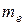 – масса электрона;
– масса электрона;
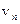 – линейная скорость электрона на орбите;
– линейная скорость электрона на орбите;
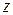 – зарядовое число ядра атома;
– зарядовое число ядра атома;
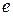 – заряд электрона;
– заряд электрона;
 – электрическая постоянная;
– электрическая постоянная;
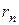 – радиус орбиты.
– радиус орбиты.
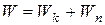 . (5.4)
. (5.4)
Кулоновская сила сообщает электрону центростремительное ускорение, т.е.
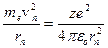 . (5.5)
. (5.5)
Из (5.5) следует, что
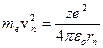 , (5.6)
, (5.6)
т.е. потенциальная энергия равна удвоенному значению его кинетической энергии:
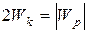 . (5.7)
. (5.7)
Подставив (5.5) в (5.4), получим:
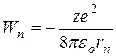 . (5.8)
. (5.8)
Для определения радиуса орбиты 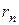 воспользуемся вторым постулатом Бора
воспользуемся вторым постулатом Бора 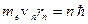 и равенством (5.5). Решив систему двух уравнений относительно
и равенством (5.5). Решив систему двух уравнений относительно 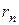 , получим:
, получим:
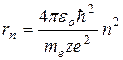 . (5.9)
. (5.9)
Таким образом rn~ n2, т.е. с ростом номера орбиты радиус ее растет. Для водорода (z=1) при n =1: 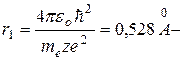 радиус первой боровской орбиты.
радиус первой боровской орбиты.
Подставив (5.9) в выражение (5.8), получим:
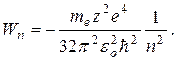 (5.10)
(5.10)
Таким образом, из выражения (5.10) следует:
¨ Полная энергия электрона в атоме отрицательна.
¨ Энергия электрона в атоме принимает дискретный ряд значений, которые представлены на рисунке 5.1
При n =1 энергия минимальна, при n →∞ энергия электрона максимальна, и он покидает атом. Атом при этом ионизируется.
Воспользуемся третьим постулатом Бора и формулой энергии электрона (5.10), определим длину волны излучения при переходе электрона из одного энергетического состояния в другое.
Длина волны связана с циклической частотой соотношением 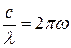 , где с – скорость света в вакууме. Поскольку
, где с – скорость света в вакууме. Поскольку 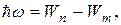 то
то 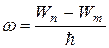 , где
, где 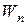 – энергия на n уровне;
– энергия на n уровне; 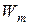 – энергия на m уровне. Причем n > m.
– энергия на m уровне. Причем n > m.
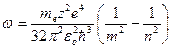 . (5.11)
. (5.11)
Для длины волны формулу (5.11) можно записать в виде:
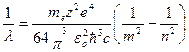 . (5.12)
. (5.12)
Обозначив 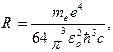 получим обобщенную формулу Бальмера:
получим обобщенную формулу Бальмера:
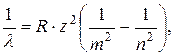 (5.13)
(5.13)
где R – постоянная Ридберга.
Теория Бора смогла объяснить факт испускания света атомом: при переходе электрона из состояния с большей энергией Wn в состояние с меньшей энергией Wm атом излучает квант энергии 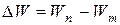 .(На рисунке 5.2 – переходы 2 и 3).
.(На рисунке 5.2 – переходы 2 и 3).
При поглощении порции энергии ΔW электрон переходит из основного состояния (n =1) в возбужденное (переход 1 на рисунке 5.2). В этом состоянии атом пребывает незначительный промежуток времени Δt~10-8 с, а затем переходит в основное состояние, причем этот переход может осуществляться ступенчато.
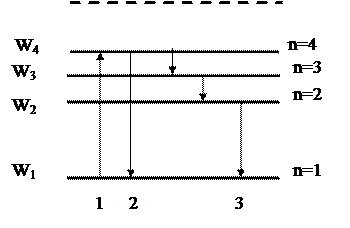 |
Рисунок 5.2 - Возможные переходы электронов в атоме.
Date: 2015-05-18; view: 876; Нарушение авторских прав