
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Основні теоретичні відомості. Бурхливий розвиток техніки ставить все нові вимоги до методів аналізу речовини
|
|
Бурхливий розвиток техніки ставить все нові вимоги до методів аналізу речовини. Так, промисловий випуск напівпровідникових матеріалів вимагає підвищення чутливості аналітичних методів для визначення надзвичайно низької концентрації домішок.
У наш час все ширше впроваджуються в практику фізичні методи діагностики. Серед них одним із основних є спектральний аналіз, який посідає провідне місце при аналітичному контролі якості продукції в різних галузях промисловості, в тому числі і в харчовій. Цей метод відрізняється великою інформативністю і високою ефективністю.
Основа спектрального аналізу – спектроскопія атомів і молекул. Спектральний аналіз класифікують за метою досліджень та типами спектрів. Так, атомний спектральний аналіз визначає елементний склад зразка за атомними (іонними) спектрами випромінювання і поглинання. Молекулярний спектральний аналіз дозволяє аналізувати молекулярний склад речовини за молекулярними спектрами поглинання, люмінесценції і комбінаційного розсіювання світла.
Емісійний спектральний аналіз проводиться за спектрами випромінювання атомів, іонів і молекул, збуджених різними способами, абсорбційний спектральний аналіз – за спектрами поглинання об’єктів, які аналізуються.
У 1913 р. Н. Бор, виходячи із планетарної моделі атома, пояснив утворення лінійчастих спектрів атомів водню. При цьому він виходив з таких постулатів.
1. Внутрішня енергія атома дискретна; вона може набувати лише певних дозволених значень (або рівнів), які характерні для певного атома. Стани атома, які відповідають цим рівням енергії, є стаціонарними. В таких станах атом не випромінює електромагнітних хвиль, незважаючи на те, що навколо ядра рухаються електрони.
2. При переході атома з одного стаціонарного стану в інший випромінюється (або поглинається) електромагнітне випромінювання, частота якого пропорційна різниці енергії Ек і Еі, які відповідають цим станам:
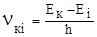 . (5.1)
. (5.1)
де h – стала Планка. Якщо перехід відбувається з вищого енергетичного рівня на нижчий, то квант електромагнітного випромінювання, енергія якого ε = 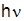 , випромінюється. При переході атома з нижчого на вищий енергетичний рівень квант енергії ε =
, випромінюється. При переході атома з нижчого на вищий енергетичний рівень квант енергії ε = 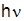 поглинається атомом (рис. 5.1).
поглинається атомом (рис. 5.1).
 |


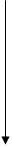
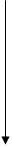
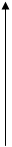
 к
к




і
Рис. 5.1
Спектри випромінювання і поглинання бувають трьох видів: лінійчасті, смугасті та суцільні. Кожний хімічний елемент має свій характерний спектр, який являє собою ніби “паспорт” елемента. Це дає змогу за спектрами встановити склад різних речовин. Особливо зручними для діагностики є лінійчасті спектри.
Вираз (5.1) часто називають правилом або умовою частот Бора. Вона є наслідком закону збереження енергії для мікроскопічних процесів випромінювання.
Отже, можливому переходу між дискретними рівнями енергії відповідає певна спектральна лінія, що характеризує в спектрі значення частоти 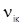 .
.
Згідно з квантовою теорією Ейнштейна між рівнями і (основним) і к (збудженим) можуть спостерігатися переходи трьох типів:
1) випромінювання (к → і) – спонтанний перехід із збудженого в більш низький енергетичний стан;
2) поглинання (і → к) – вимушений перехід із нижчого на вищий енергетичний рівень, в результаті впливу зовнішнього випромінювання з частотою 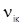 ;
;
3) індуктивне випромінювання (к → і) – вимушений перехід із збудженого на більш низький енергетичний рівень індукованого в результаті впливу зовнішнього випромінювання тієї самої частоти, що й частота випромінювання 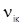 . Кожний окремий перехід, поряд із частотою переходу (1), характеризується ймовірністю випромінювання при переході з вищого енергетичного рівня. Інтенсивності ліній у спектрі залежать від ймовірностей окремих переходів і заселеності різних рівнів енергії.
. Кожний окремий перехід, поряд із частотою переходу (1), характеризується ймовірністю випромінювання при переході з вищого енергетичного рівня. Інтенсивності ліній у спектрі залежать від ймовірностей окремих переходів і заселеності різних рівнів енергії.
Коли середовище перебуває в термодинамічній рівновазі при температурі Т, розподіл атомів за енергетичними рівнями описується законом Больцмана.
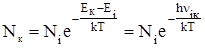 , (5.2)
, (5.2)
де Nк, N i кількість атомів, які перебувають відповідно у збудженому стані і основному; k – стала Больцмана
Для переведення атома із основного стану в збуджений необхідно надати йому енергію.
Атомна система не може перебувати в збудженому стані безмежно довго. Вона віддає енергію у вигляді випромінювання фотонів і, отже, має скінченний час життя у більшості випадків ~ 10-7 с.
За час життя атома в збудженому стані він може стикатися з іншими частинками, що може призвести до погашення збудження, при цьому внутрішня енергія атома йде на збільшення кінетичної енергії іншої частинки. Такі зіткнення зменшують інтенсивність спектральних ліній.
Перевести атом із основного стану в збуджений можна різними способами: при дії світлом (фотозбудження); при теплових зіткненнях із важкими частинками (атомами, молекулами) в умовах високих температур; при зіткненнях з електронами в умовах газового розряду; при проходженні різних хімічних реакцій тощо.
У даній роботі для одержання збуджених атомів використовується газовий розряд при низькому тиску (важливою характеристикою такого розряду є відсутність теплової рівноваги між електронами і важкими частинками (атомами, іонами)). При пружних співударах електронів з атомами, молекулами та іонами кінетична енергія електрона передається цим чайникам, і вони переводяться в збуджений стан. При переході із збудженого стану в стаціонарний атоми (молекули) випромінюють фотони різної енергії, що відповідає даному газу.
Для розкладання випроміненого газом світла в спектр можна використати явища дифракції або дисперсії.
У багатьох спектроскопах – приладах для одержання і спостереження спектрів – використовується саме явище дисперсії.
Під дисперсією світла розуміють залежність показника заломлення середовища n від довжини хвилі λ, або залежність швидкості поширення хвилі від довжини хвилі в різних середовищах:
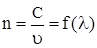 , (5.3)
, (5.3)
де С, 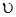 – відповідно швидкість поширення світла у вакуумі і в даному середовищі.
– відповідно швидкість поширення світла у вакуумі і в даному середовищі.
Явище дисперсії можна спостерігати при проходженні світла крізь прозору призму Р (рис. 5.2). У цьому разі значення n збільшується із збільшенням частоти світла ν (зменшенням λ), чому і відповідає розподіл кольорів в спектрі на екрані Е (Ч – червоний, Ф - фіолетовий). Така залежність n від λ називається нормальною дисперсією світла, яка досить добре описується співвідношенням
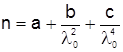 , (5.4)
, (5.4)
де λ0 – довжина хвилі у вакуумі; а, в, с – сталі, які для кожної речовини визначаються експериментально.

 Р Е
Р Е
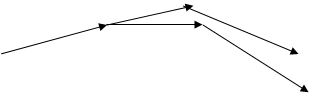 |
Ч
Ф
Рис. 5.2
Якщо пустотілу прозору призму заповнити парою йоду і пропустити крізь неї біле світло, то сині промені заломляться менше, ніж червоні. Тобто в даному випадку показник заломлення n збільшується зі збільшенням довжини хвилі λ.Таку дисперсію називають аномальною.
Явище дисперсії добре описується як класичною, так і квантовою теорією взаємодії світла з речовиною.
Схема спектроскопа показана на рис. 5.3. Він складається із дисперсійної призми Р, яка розміщена на столику приладу, коліматорної трубки D та зорової трубки ЗТ. У коліматорній трубці в фокальній площині є щілина, ширину якої можна регулювати. Зорова труба складається з об’єктива L2 і окуляра Ок.
Рис. 5.3
Якщо перед щілиною коліматорної трубки помістити джерело світла S, то розбіжний пучок світла, який пройде через щілину, потрапить на збірну лінзу L1. Вона перетворить його в паралельний пучок, який падає на грань дисперсної призми Р і розкладається на розбіжні пучки монохроматичних променів. Останні, пройшовши крізь призму, на другій грані призми заломлюються, виходять з неї із більшим кутом розходження. Ці розбіжні пучки об’єктивом окуляра зорової труби перетворюються у збіжні і дають дійсне зображення освітленої щілини коліматорної трубки в кольорових променях у вигляді сукупності різнокольорових смуг (або ліній). Отримана картина називається спектром світла джерела, яке освітлює щілину. Спектр світла можна спостерігати за допомогою окуляра у збільшеному вигляді. У полі зору окуляра є візирний покажчик. Зорову трубку можна повертати за допомогою мікрометричного гвинта і встановлювати візирний покажчик на відповідну спектральну лінію, що дає змогу вимірювати кути між окремими лініями спектра.
Потрібне устаткування: спектроскоп, набір газорозрядних трубок з відомими і невідомими газами і пусковий пристрій, джерело постійного струму.
Date: 2015-05-18; view: 656; Нарушение авторских прав