
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Расчет энергетических состояний атома водорода, выполненный Н.Бором
|
|
Правило квантования, приводящее к правильным, согласующимся с опытом значениям энергий стационарных состояний атома водорода, было угадано Бором. Бор предположил, что выполняется следующее соотношение между скоростью движения электрона и радиусом орбиты:
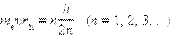
Здесь me – масса электрона, v– его скорость, rn – радиус стационарной круговой орбиты.
Правило квантования Бора позволяет вычислить радиусы стационарных орбит электрона в атоме водорода и определить значения энергий. Скорость электрона, вращающегося по круговой орбите некоторого радиуса r в кулоновском поле ядра, как следует из второго закона Ньютона, определяется соотношением (вспомните про центростремительное ускорение и силу Кулона mv2/r=ke2/r2): 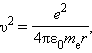 где e – элементарный заряд, eo – электрическая постоянная. Скорость электрона v и радиус стационарной орбиты rn связаны правилом квантования Бора. Отсюда следует, что радиусы стационарных круговых орбит определяются выражением
где e – элементарный заряд, eo – электрическая постоянная. Скорость электрона v и радиус стационарной орбиты rn связаны правилом квантования Бора. Отсюда следует, что радиусы стационарных круговых орбит определяются выражением
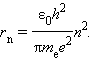
Самой близкой к ядру орбите соответствует значение n = 1. Радиус первой орбиты, который называется боровским радиусом, равен
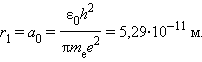
Радиусы последующих орбит возрастают пропорционально n2.
Полная механическая энергия E системы из атомного ядра и электрона, обращающегося по стационарной круговой орбите радиусом rn, равна
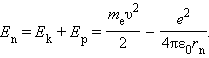
Следует отметить, что Ep < 0, так как между электроном и ядром действуют силы притяжения. Подставляя в эту формулу выражения для v2 и rn, получим:
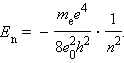
Целое число n = 1, 2, 3,... называется в квантовой физике атома главным квантовым числом.
Прекрасное согласие боровской теории атома водорода с экспериментом служило веским аргументом в пользу ее справедливости. Однако попытки применить эту теорию к более сложным атомам не увенчались успехом. Бор не смог дать физическую интерпретацию правилу квантования.
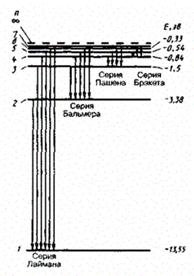 Постулаты Бора противоречат законам классической физики. Они выражают характерную особенность микромира - квантовый характер происходящих там явлений. Выводы, основанные на постулатах Бора, хорошо согласуются с экспериментом. Например, объясняют закономерности в спектре атома водорода, происхождение характеристических спектров рентгеновских лучей и т.д. На рис. 3 показана часть энергетической диаграммы стационарных состояний атома водорода.
Постулаты Бора противоречат законам классической физики. Они выражают характерную особенность микромира - квантовый характер происходящих там явлений. Выводы, основанные на постулатах Бора, хорошо согласуются с экспериментом. Например, объясняют закономерности в спектре атома водорода, происхождение характеристических спектров рентгеновских лучей и т.д. На рис. 3 показана часть энергетической диаграммы стационарных состояний атома водорода.
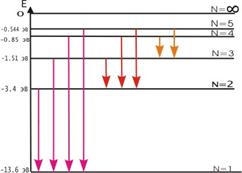 Рис. 3.
Рис. 3.
Стрелками показаны переходы атома, приводящие к излучению энергии. Видно, что спектральные линии объединяются в серии, различающиеся тем, на какой уровень с других (более высоких) происходит переход атома.Формула Ридберга для серии Бальмера выглядит следующим образом: 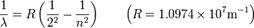
| <== предыдущая | | | следующая ==> |
| Вопр 19 Рынки видов сделок | | | Сергей Макаров |
Date: 2015-05-18; view: 1176; Нарушение авторских прав