
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Изотермы Эндрюса и Ван-Дер-Ваальса. Метастабильные сотояния. Физический смысл критического сотояния
|
|
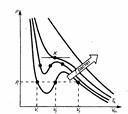 Для исследования поведения реального газа рас-м изотермы Ван-дер-Ваальса — кривые зависимости р от V m при заданных Т, определяемые уравнением Ван-дер-Ваальса
Для исследования поведения реального газа рас-м изотермы Ван-дер-Ваальса — кривые зависимости р от V m при заданных Т, определяемые уравнением Ван-дер-Ваальса 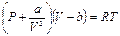 для моля газа.При высоких темп-рах (T > T к) изотерма реального газа отличается от изотермы идеального газа только некоторым искажением ее формы, оставаясь монотонно спадающей кривой. При некоторой температуре T к на изотерме имеется лишь одна точка перегиба К. Эта изотерма называется критической( T к); точка перегиба К называется критической точкой.Соответствующие этой точке объем V к, и давление р к называются также критическими. Состояние с критическими параметрами (p к, V к, T к) называется критическим состоянием. При низких темп-рах (Т < T к) изотермы имеют волнообразный участок.Для пояснения характера изотерм преобразуем уравнение Ван-дер-Ваальса к виду
для моля газа.При высоких темп-рах (T > T к) изотерма реального газа отличается от изотермы идеального газа только некоторым искажением ее формы, оставаясь монотонно спадающей кривой. При некоторой температуре T к на изотерме имеется лишь одна точка перегиба К. Эта изотерма называется критической( T к); точка перегиба К называется критической точкой.Соответствующие этой точке объем V к, и давление р к называются также критическими. Состояние с критическими параметрами (p к, V к, T к) называется критическим состоянием. При низких темп-рах (Т < T к) изотермы имеют волнообразный участок.Для пояснения характера изотерм преобразуем уравнение Ван-дер-Ваальса к виду 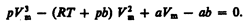 Уравнение при заданных р и Т является уравнением третьей степени относительно V m.Первому случаю соответствуют изотермы при низких темп-рах (три значения объема газа V 1, V 2 и V 3 отвечают одному значению давления р 1), второму случаю -изотермы при высоких темп-рах.Вещество в газообразном состоянии при температуре ниже критической называется паром, а пар, находящийся в равновесии со своей жидкостью, называется насыщенным. Данные выводы, следующие из анализа уравнения Ван-дер-Ваальса, были подтверждены опытами ирландского ученого Т. Эндрюса.Отличие экспериментальных (Эндрюс) и теоретических (Ван-дер-Ваальс) изотерм заключается в том, что превращению газа в жидкость в первом случае соответствуют горизонтальные участки, а во втором — волнообразные. Для нахождения критических параметров подставим их значения в уравнение и запишем
Уравнение при заданных р и Т является уравнением третьей степени относительно V m.Первому случаю соответствуют изотермы при низких темп-рах (три значения объема газа V 1, V 2 и V 3 отвечают одному значению давления р 1), второму случаю -изотермы при высоких темп-рах.Вещество в газообразном состоянии при температуре ниже критической называется паром, а пар, находящийся в равновесии со своей жидкостью, называется насыщенным. Данные выводы, следующие из анализа уравнения Ван-дер-Ваальса, были подтверждены опытами ирландского ученого Т. Эндрюса.Отличие экспериментальных (Эндрюс) и теоретических (Ван-дер-Ваальс) изотерм заключается в том, что превращению газа в жидкость в первом случае соответствуют горизонтальные участки, а во втором — волнообразные. Для нахождения критических параметров подставим их значения в уравнение и запишем 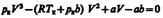 . Поскольку в критической точке все три корня совпадают и равны V к уравнение приводится к виду
. Поскольку в критической точке все три корня совпадают и равны V к уравнение приводится к виду 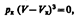
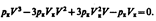 Tax как эти уравнения тождественны, то в них должны быть равны и коэф-ты при неизвестных соответствующих степеней. Поэтому можно записать
Tax как эти уравнения тождественны, то в них должны быть равны и коэф-ты при неизвестных соответствующих степеней. Поэтому можно записать
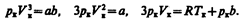 Решая полученные уравнения, найдем
Решая полученные уравнения, найдем 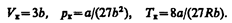
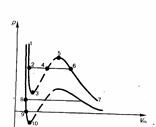 Сравнивая изотерму Ван-дер-Ваальса с изотермой Эндрюса (верхняя кривая на рис2), видим, что последняя имеет прямолинейный участок 2 — 6, соответствующий двухфазным состояниям вещества. Правда, при некоторых условиях могут быть реализованы состояния, изображаемые участками ван-дер-ваальсовой изотермы 5— 6 и 2 — 3. Эти неустойчивые состояния называются метастабильными
Сравнивая изотерму Ван-дер-Ваальса с изотермой Эндрюса (верхняя кривая на рис2), видим, что последняя имеет прямолинейный участок 2 — 6, соответствующий двухфазным состояниям вещества. Правда, при некоторых условиях могут быть реализованы состояния, изображаемые участками ван-дер-ваальсовой изотермы 5— 6 и 2 — 3. Эти неустойчивые состояния называются метастабильными
Date: 2015-05-09; view: 3563; Нарушение авторских прав