
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

История развития представлений о микромире. Свойства и характеристики основных микрочастиц
|
|
В ХVIII веке существовало представление о том, что весь материальный мир состоит из мельчайших нейтральных - то есть не имеющих заряда – частиц, названных атомами. Данное название свидетельствует о том, что атомы полагали элементарными частицами микромира, то есть не имеющими структуры, неделимыми (атом, в переводе с латинского – неделимый). Подобные представления считались незыблемыми вплоть до конца XIX века, когда оказалось, что у атома есть внутренняя структура. В значительной степени этому способствовало развитие взглядов на такое физическое явление как свет.
Еще в ХVΙΙ веке Исаак Ньютон, учитывая прямолинейный характер распространения света, высказал предположение о том, что свет–это поток особых частиц – корпускул (от лат. сorpusculum – тельце). На основе своей теории Ньютон смог объяснить законы отражения и преломления света, но объяснить явление хромизма, т.е. многоцветности зрительных ощущений, он не смог. Тем не менее, корпускулярная теория света на длительный период заняла главенствующее положение в физике, несмотря на то, что были и другие гипотезы, в частности, современник Ньютона Христиан Гюйгенс полагал, что свет является волновым процессом, и на основе волновых представлений также смог дать объяснение законам отражения и преломления света.
Корпускулярная теория существовала до тех пор, пока Томас Юнг (1773 – 1829) а затем и Огюстен Френель (1788 - 1827) в начале XIX века не установили, что свет способен огибать непрозрачные препятствия, а наложение световых пучков друг на друга приводит к их взаимному усилению или ослаблению. Подобные явления к тому времени были хорошо изучены на примере акустических (звуковых) волн и волн, образующихся на поверхности воды, и носили названия дифракции и интерференции соответственно. Данные явления корпускулярная теория объяснить не смогла, в отличие от волновой теории. Отсюда возникла и надолго получила широкое распространение в классической (в смысле – доквантовой) физике волновая теория света, согласно которой свет рассматривался как волновой процесс, имеющий непрерывный характер.
Долгое время полагали, что свет распространяется как звук, т.е. представляет собой продольные колебания некоего «эфира». Однако эксперименты с прозрачными кристаллами (чаще всего использовался так называемый исландский шпат – углекислый кальций) привели к пониманию того, что свет представляет собой поперечные колебания – как тогда считали - «светоносного эфира», лежащие в плоскости, перпендикулярной к направлению распространения света (светового луча). Причем, эти колебания происходили в этой плоскости под самыми разными углами. Свет, у которого эти колебания совершаются в рассматриваемой плоскости в различных направлениях, беспорядочно, назвали естественным или неполяризованным (неполяризованным, к примеру, является солнечный свет), а свет, у которого колебания имеют только одно направление, - линейно - поляризованным (термин «поляризация» ввел французский физик Этьен-Луи Малюс). Свет может иметь также круговую, либо эллиптическую поляризацию, если направление колебаний регулярно изменяется по определенному закону. Открытие явления поляризации позволило в дальнейшем определить физическую природу света.
В 1845г. Майкл Фарадей установил, что различные прозрачные вещества, помещенные внутри электромагнита и освещаемые поляризованным светом, при возникновении поля начинали вдруг вращать плоскость поляризации (плоскость, в которой лежат векторы направления колебаний и направления распространения света), что приводило к изменению интенсивности света. Обдумывая результаты этих опытов, Джемс Максвелл (1868) пришел к выводу, что столь явное взаимодействие света и магнитного поля происходит по той причине, что свет – это электромагнитные волны (ЭМВ), рождаемые движением заряженных частиц, вокруг которых, как следствие этого движения, возникает электромагнитное поле. Однажды возникнув, поле перемещается в пространстве в виде электромагнитных колебаний, колебаний электрического и магнитного полей, поперечных направлению распространения волны, волны колебаний. Такие колебания могут перемещаться в пустоте, им не нужен эфир, и они могут взаимодействовать с другими электромагнитными колебаниями. Причем, по мнению Максвелла, свет – лишь один из видов электромагнитных колебаний, существующих в природе.
В 1888г. Генрих Герц опытным путём обнаружил существование ЭМВ и показал, что их свойства подобны свойствам световых волн, поскольку скорость их распространения такая же, как у света, а на границе раздела сред они (ЭМВ) претерпевают отражение и преломление. Кроме того, для них, как и для света, характерно явление поляризации. То обстоятельство, что в опыте Герца в разряднике удалённого контура проскакивала искра, прямо указывало, что ЭМВ обладают энергией, которую они отдают окружающей среде в процессе поглощения. Например, в результате поглощения этой энергии сетчатой глаза возникает зрительное ощущение, а излучение электромагнитной энергии нагретым телом вызывает ощущение тепла.
Таким образом, была доказано, что свет представляет собой электромагнитное излучение.
Значительно медленнее шли процессы в области исследования атома. Представление об атомах как о неделимых частицах просуществовало вплоть до 1897 года, в котором Дж. Дж. (Джон Джон) Томсон сделал сообщение об открытии им частиц, меньших, чем атомы, и имеющих отрицательный заряд. Открытие Томсона подтвердило верность гипотезы Вениямина Франклина, который ещё в 1750 году на основании результатов исследования громоотводов полагал: «Электрическая материя состоит из чрезвычайно тонких частиц». Имя «электрон» для этих гипотетических частиц было предложено последователем учения Франклина американским физиком Джонстоном Стони за шесть лет до томсоновского сообщения.
С открытием Томсоном электронов возник вопрос – как устроен атом, почему он является электрически нейтральной частицей, и нет ли в его составе положительно заряженной субстанции, заряд которой компенсирует суммарный отрицательный заряд электронов.
Ответ был получен Эрнестом Резерфордом в ходе эксперимента, проделанного в 1909 году.
Чрезвычайно тонкую золотую пластинку – настолько тонкую, что в её поперечном сечении располагалось менее ста атомов, подвергали бомбардировке α-частицами, полученными в процессе естественного радиоактивного распада урана. Эти частицы имеют положительный заряд, в два раза больший заряда электрона, и массу, равную учетверённой массе атома водорода. Скорость их вылета из радиоактивного атома 10-20км / с, следовательно, они обладают огромной энергией.
Если наличие положительного заряда внутри атома имело бы место, то в соответствии с законом Кулона α-частица должна была потерять часть своей энергии и отклониться от своего первоначального направления на некоторый угол (физики говорят – рассеялась на такой-то угол). Величина угла рассеяния должна зависеть от того, на каком расстоянии от центра положительно заряженной области пролетала α-частица внутри атома. Для наблюдения за результатом такого рассеяния вокруг пластины под разными углами по отношению к первоначальному направлению движения α-частиц к пластине были расставлены экраны, изготовленные из сернистого цинка. При попадании на них рассеявшихся α-частиц возникали голубоватые вспышки вследствие явления люминесценции, которые регистрировались, и определялись углы рассеяния.
В подавляющем большинстве случаев углы рассеяния были невелики. Но даже эти малые отклонения свидетельствовали о существовании внутри атома значительных силовых полей. Как показали расчёты, для отклонения частицы всего на два градуса требовалось воздействие на неё силового поля напряженностью 100 000 вольт на сантиметр. Но, в ходе эксперимента выяснилось, что примерно одна из восьми тысяч α-частиц возвращалась назад, то есть рассеивалась на углы, близкие к 180 градусам. Со слов Резерфорда: «То было почти столь же неправдоподобно, как если бы вы произвели выстрел по обрывку папиросной бумаги 15-дюймовым снарядом, а он вернулся бы назад и угодил в вас», и далее: «Внутри атома должны действовать ужасающие силы...». Наличие этих сил, сил отталкивания, подтверждало факт существования внутри атома некоей положительно заряженной области, а то, что только одна из восьми тысяч α-частиц попадало прямо в неё, свидетельствовало о малости этой области в сравнении с размером самого атома.
Так родилась идея положительно заряженного атомного ядра. Последующие эксперименты позволили установить, что радиусы ядер ·различных элементов варьируют в пределах от 2·10-15м для лёгких элементов до 10-14м для тяжёлых элементов. Линейные же размеры атомов составляют величину порядка 10-10м. Столь большая разница в размерах атома и его ядра позволила Э. Резерфорду сказать, что атом «пустой».
С открытием ядра атома сразу же возник вопрос о поведении электронов в атоме и их взаимодействии с ядром. Было совершенно очевидно, что электроны не могут находиться в неподвижном состоянии, так как в этом случае они должны быть притянутыми к ядру вследствие действия кулоновых сил, что означало практически исчезновение атома и материи как таковой. Поэтому первоначально возникла идея планетарной модели атома, согласно которой электроны должны были как планеты вращаться вокруг ядра, чтобы центробежные силы уравновешивали силы кулоновского притяжения к нему. Однако несостоятельность этой модели сразу стала очевидной: согласно классическим представлениям движение с ускорением (в данном случае – центробежным) должно сопровождаться потерей энергии на электромагнитное излучение, и электрон, вращаясь, непрерывно терял бы её, уменьшая радиус вращения, и в конце концов упал бы на ядро, и атом, а вместе с ним и материя как таковая, перестали бы существовать. Таким образом, вопрос об устойчивости атома оставался открытым.
Но материя не исчезала, следовательно, атом оставался устойчивым, а это означало, что электронам удавалось противодействовать силам притяжения к ядру. Сделать это они могли только при условии непрерывного движения, что указывало на наличие у них энергии. Причём, эта энергия должна быть тем больше чем дальше от ядра находится электрон. На тот момент вопрос о траекториях электронов не стоял, и их по привычке, связанной с планетарной моделью, называли орбитами.
Решению проблемы устойчивости во многом способствовал багаж знаний, накопленных к тому времени в процессе изучения света. Уже были получены атомные спектры, своего рода «визитные карточки атомов», Для водородного спектра была разработана в 1885г. т.н. формула Бальмера (Иоган Якоб Бальмер), которая путём подстановки в неё целых чисел позволяла получать значения частот электромагнитных колебаний для различных цветов спектральных линий. Однако физическая природа атомных спектров оставалась неизвестной. Кроме того, в начале XX столетия обнаружилось, что в ряде случаев расчёты, выполненные на основе волновых представлений, не совпадают с практикой. Так, долгое время не удавалось получить формулу для распределения энергии в спектре излучения нагретого тела для практически бесконечного диапазона длин волн. Существовал ряд формул для отдельных их диапазонов, полученных исходя из классических представлений, согласно которым волна является непрерывным процессом, занимающим, к тому же, всё пространство, но ни одна из них не давала точных результатов для всего диапазона. Решение было найдено Максом Планком в 1900г. ценой отказа от классических представлений, в предположении, что свет испускается отдельными порциями, порциями энергии, которые Планк назвал квантами (от нем. Quantum – количество, порция). В итоге формула Планка в широком диапазоне длин волн излучения показала хорошее согласие с экспериментальными данными.
Волновая теория не смогла также объяснить результаты экспериментов, в ходе которых было открыт внешний фотоэффект – явление испускания электронов металлами. Впервые его наблюдал Г.Герц в 1887г., а тот факт, что испущенные частицы были электронами, установил Дж. Дж. Томсон в 1898г. Обобщив результаты проделанных исследований, Альберт Эйнштейн пришёл к выводу, что экспериментальные результаты можно легко объяснить, если предположить, что свет не только испускается порциями – квантами, как предположил М.Планк, но и поглощается такими же порциями. Причём Эйнштейн провозгласил физическую реальность квантов, называя их «частицами излучения, корпускулами», сохраняющими в пространстве свою целостность.
Таким образом, стало понятно, что свет – это сложное явление, которому присущи как волновые, так и корпускулярные свойства. Первые проявляют себя в дифракции и интерференции, вторые в прямолинейности распространения и «умении» выбивать (а не «вымывать», как это сделали бы волны) электроны из металла. Такую двойственность свойств стали называть корпускулярно-волновым дуализмом (КВД) – от англ.dual – двойственный, двойной.
Таким образом, начало XX века совпало с появлением квантовой механики, и надо полагать, что она сыграла свою роль в решении проблемы устойчивости атома.
В 1913г. датский физик Нильс Бор, исходя из квантовых представлений и основываясь на анализе атомных спектров и формулы Бальмера, высказал гипотезу о том, что у атома (и его электронов) имеется некоторый дискретный набор разрешённых (Природой) орбит и уровней энергии. На этих орбитах электрон при своём движении не излучает, а значит, не теряет энергию, и атом остаётся устойчивым. Переход с одной стационарной орбиты на другую происходит мгновенно, скачком, при этом, если электрон переходит на более высокую орбиту, то этот переход вызывается поглощением атомом энергии, а при переходе на более низкую орбиту сопровождается испусканием энергии в виде ЭМИ. При этом энергия испускается или поглощается определёнными порциями или квантами, что на тот момент также шло вразрез с классическими преставлениями, согласно которым энергия, как и любая другая физическая величина, считалась величиной непрерывной и не могла меняться скачками. Величина кванта ЭМИ по Бору равна разности энергий тех стационарных состояний, между которыми совершается квантовый скачок электрона:
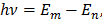 (1)
(1)
где 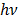 - величина кванта ЭМИ:
- величина кванта ЭМИ: 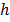 - постоянная Планка,
- постоянная Планка, 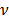 - частота ЭМИ;
- частота ЭМИ; 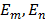 - уровни энергии электронов на m-ой и n-ой орбитах.
- уровни энергии электронов на m-ой и n-ой орбитах.
. Теория Бора позволила объяснить происхождение атомных спектров и находилась в полном соответствии с формулой Бальмера.
Однако, в теории Бора был, по выражению Э. Резерфорда, «...серьёзный камень преткновения...», сущность которого заключалась в следующем. У атома несколько разрешённых состояний, несколько орбит электронов на разных расстояниях от ядра. И электрон перескакивает с удалённой от ядра орбиты на какую–то более близкую, но на какую? Откуда электрону знать – на какой орбите остановиться, и какой квант он должен испустить? Кроме того, была ещё одна проблема: электроны-планеты двигались вокруг солнца-ядра по законам классической механики, их движение было непрерывным, но, совершая скачки между орбитами, излучали свет по квантовому закону Планка, т.е. сочеталось несочетаемое.
К тому времени уже сложилось представление о свете как о сложном явлении, сочетающем в себе как волновые, так и корпускулярные свойства. В 1924 г. французский физик Луи де Бройль предположил наличие такой же двойственности и у всего материального мира, и, в том числе, у электрона, который мог быть связанным с какой-то волной. Если это так, то для того, чтобы электрон был устойчив – в смысле не излучал на орбите, необходимо, чтобы на ней укладывалось целое число электронных волн (целое число периодов колебаний). То есть, если электрон «засечь» в какой-то точке орбиты и в этой точке, допустим, был гребень волны, то, при совершении электроном целого оборота, в этой точке также должен быть гребень. Тогда эта орбита будет разрешённой, а при несоблюдении данного условия – неразрешённой. Таким образом, из всех возможных орбит электрона дозволены лишь те, чья длина кратна длине волны электрона, лишь на таких орбитах он может двигаться вечно, не излучая, следовательно, состояние атома будет устойчивым.
Если энергия электрона 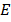 , находящегося на данной орбите известна и известен его импульс p, то длина его волны λ, «волны де Бройля», находится следующим образом:
, находящегося на данной орбите известна и известен его импульс p, то длина его волны λ, «волны де Бройля», находится следующим образом:
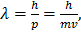 (2)
(2)
а частота
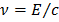 , (3)
, (3)
где  – скорость света.
– скорость света.
Теория де Бройля была подтверждена в опытах американского физика Клинтона Джозефа Дэвиссона и английского – Джорджа Пейджета Томсона в 1927г. независимо друг от друга. В частности, в опыте Д.П. Томсона пучок электронов, разогнанный до энергии порядка десятка килоэлектронвольт, пронизывал тонкую золотую фольгу и попадал на фотопластинку, на которую электрон оказывает такое же действие, что и фотон. В результате на фотопластинке возникала дифракционная картина, подобная той, которую получил Исаак Ньютон в опытах со светом, известная как «кольца Ньютона». Измерения, выполненные на электронограмме, совпали с расчётными значениями, найденными по (2), (3).
Полупроводник – это (чаще всего) твердое вещество с атомной кристаллической структурой. Атомные кристаллы образуются за счет ковалентных (парноэлектронных) связей между атомами решетки кристалла. Ковалентная связь возникает при малых расстояниях между ядрами – менее 0,2нм, когда имеет место перекрытие электронных оболочек атомов. Ковалентные связи имеют такие полупроводники как германий, кремний, фосфид галлия и др. Отличительной особенностью полупроводников является то обстоятельство, что их электропроводность может изменяться в широком диапазоне, приближаясь в соответствующих состояниях либо к проводникам, либо к техническим диэлектрикам. Существуют также органические полупроводники, которые в настоящее время находят все большее применение.
Date: 2015-05-09; view: 2538; Нарушение авторских прав