
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Характеристика элементов по классам, исходя из электронной конфигурации атома
|
|
Характеристика элемента включает определение его свойств (металл или неметалл), валентностей, степеней окисления, составление основных классов соединений, исходя из степени окисления элемента.
Характеристика s-элемента, на примере магния
Mg+12 1s2 2s2 2p6 3s2 валентные электроны
| ¯ | 3p |
3s Строение валентных электонов (нормальное состояние – с.о.= 0)
Mg – металл (так как число валентных электронов £ 2)
При взаимодействии с квантами поля атомы легко переходят в возбужденное состояние, при этом происходит перескок электрона в пределах своего энергетического уровня:
Mg* возбужденное состояние
| | |||
| | 3p |
3s
По числу неспаренных электронов определяют валентность т. е. число химических связей атома с другими атомами. Она, как правило, соответствует степени окисления (с.о.)
с.о.=+2 (равна валентности или числу неспаренных электронов)
Mg+2O ® Mg2+(OH)-2 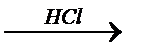 Mg2+Cl-2
Mg2+Cl-2
оксид Mg гидроксид Mg хлорид Mg
Характеристика р элемента, на примере серы
S+16 1s2 2s2 2p6 3s2 3p4 валентные электроны
| 3S | ¯ | | |
| ¯ | 3p |
Строение валентных электонов (нормальное состояние – с.о.= 0).
S – неметалл (число валентных электронов ³ 4). По числу неспаренных электронов можно определить валентность II. Ей соответствует с.о.= +2 (неустойчива) и с.о.= -2, например, в соединении H2S.
S* возбужденное состояние
| | ||||||||
| | | | 3d | |||||
| ¯ | 3p |
3s
с.о.= +4 (равна валентности или числу неспаренных электронов)
S+4O2 H2SO3 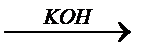 K2SO3
K2SO3
оксид S(IV) сернистая кислота сульфит калия
S**второе возбужденное состояние
| | | |||||||
| | | | 3d | |||||
| | 3p |
3s
с.о.= +6 (равна валентности или числу неспаренных электронов)
S+6O3 H2SO4 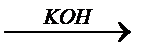 K2SO4
K2SO4
оксид S(VI) серная кислота сульфат калия
Характеристика р элемента, на примере алюминия
Al+13 1s2 2s2 2p6 3s2 3p1
валентные электроны
| | |||
| ¯ | 3P | 3 |
3s Строение валентных электонов (нормальное состояние – с.о.= 0).
Al – амфотерный металл (амфотерность чаще проявляется для атомов с числом валентных электронов равным 3 или 4). По числу неспаренных электронов можно определить с.о.=+1, однако для элементов III группы главной подгруппы с.о.= +1 неустойчива.
Al* возбужденное состояние
| | | ||
| | 3p |
3s с.о.=+3 (равна валентности)
Al+3 2O3® Al3+(OH)-3 
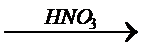 Al(NO3)3
Al(NO3)3
амф.оксид Al гидроксид Al нитрат алюминия
HAlO2 
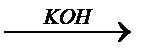 KAlO2
KAlO2
метаалюминевая кислота метаалюминат калия
Амфотерные свойства характерны также и для р-элементов с большим радиусом атома. Это Ge, As, Sn, Sb, Te, Pb, Bi, Po.
Характеристика d элемента, на примере железа
Fe+26 1s2 2s2 2p6 3s2 3p6 3d6 4s2 валентные электроны
| ¯ | |||||||||
| ¯ | | | | | 4s | ||||
3d
Строение валентных электрнов (нормальное состояние – с.о.= 0).
Fe – металл (так как число валентных электронов на внешнем уровне £2)
Fe* возбужденное состояние
| | |||||||||
| | 4p | p | |||||||
| ¯ | | | | | 4s | ||||
3d
Данная модель представления о строении валентных электронов позволяет для d семейства элементов определить только максимальную и минимальную степень окисления в возбужденном состоянии.
min с.о.=+2 (количество неспаренных электронов на внешнем уровне)
max c.o.=+6 (общее количество неспаренных валентных электронов)
Fe+2O Fe2+(OH)-2  Fe2+Cl-2
Fe2+Cl-2
оксид Fe(II) гидроксид Fe(II) хлорид Fe(II)
В высшей степени окисления, когда частица теряет ³ 4 (в нашем случае 6 электронов), изменяется энергия связи оставшихся валентных электронов и ядра, уменьшается радиус частицы. Поэтому в высших степенях окисления оксиды и гидроксиды d-элементов проявляют кислотные свойства.
Fe+6O3 H2 FeO4 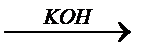 K2 FeO4
K2 FeO4
оксид Fe(VI) железная кислота феррат калия
Рекомендуемая литература: [1], с. 37-96; [2], с.17-34.
Date: 2015-05-09; view: 1121; Нарушение авторских прав