
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

К разделу 1
|
|
1. Единица давления -1 атмосфера равна:
а. Примерно 0,1 МПа.
b. 1 Па.
c. 1 МПа.
d. 760 мм рт.ст.
2. Закону Бойля - Мариотта соответствует соотношение:
а. p1 / p2 = v2 / v1.
b. p1 / p2 = T1 / T 2.
c. p1 / p2 = v1 / v2.
d. v1 / v2 = T1 / T2.
3. Закону Гей- Люссака соответствует соотношение:
а. p1 / p2 = v2 / v1.
b. p1 / p2 = T1 / T 2.
c. v1 / v2 = T1 / T2.
d. p1 / p2 = v1 / v2.
4. Закону Шарля соответствует соотношение:
а. p1 / p2 = v2 / v1.
b. p1 / p2 = v1 / v2.
c. p1 / p2 = T1 / T 2.
d. v1 / v2 = T1 / T2.
5. Закону Авогадро означает, что:
а. Моли различных идеальных газов при одинаковых давлениях и температурах занимают одинаковый объем.
b. Моли различных идеальных газов при одинаковых давлениях занимают одинаковый объем.
c. Моли различных идеальных газов при одинаковых мольных массах занимают одинаковый объем.
d. Моли различных идеальных газов при нормальных физических условиях занимают объем, равный 22.4 м3.
6. Связь газовой постоянной R с теплоемкостями cр и cv выражается зависимостью:
а. c p - c v
b. cp
c. c p + cv
d. cp / cv
7. Теплоемкость представляет собой отношение подведенного:
а. к телу количества теплоты к достигнутой разности температур тела.
b. к телу количества теплоты к величине изменения внутренней энергии тела.
c. к телу количества теплоты к величине изменения давления тела.
d. к телу количества теплоты к величине изменения энтальпии тела.
8. Смесь идеальных газов представляет собой:
а. материю, состоящую из химически инертных идеальных газов.
b. субстанцию, составляющую сумму одинаковых количеств молей различных сред.
c. субстанцию, содержащую различные легкие газы.
d. материю, состоящую из химически взаимодействующих
легких газов.
9. Смесь идеальных газов может быть задана при помощи:
а. массовых и объемных долей.
b. парциальных давлений компонентов.
c. парциальных (приведенных) объемов.
d. в виде суммы мольных масс компонентов.
10. Показатель политропы при изотермическом процессе равен:
а. n=1.
b. n=0.
c. n=oo.
d. n=k.
11. Показатель политропы при адиабатном процессе равен:
a. n=k.
b. n=0.
c.n=oo.
d. n=1.
12. Показатель политропы при изобарном процессе равен:
а. n=0.
b. n=1.
c.n=oo.
d.n=k.
13. Показатель политропы при изохорном процессе равен:
a. n=oo.
b. n=0.
c.n=1.
d.n=k.
14. Теплоемкость идеального газа при изотермическом процессе равна:
а. с=oo.
b. с=0.
c. с=1.
d. с=k.
15. Теплоемкость идеального газа при изобарном процессе равна:
а. с=cp.
b. с=0.
c. с=cp.
d. с=k.
16.. Теплоемкость идеального газа при изохорном процессе равна:
а. с= cv.
b. с=0.
c. с= cp.
d. с=k.
17. Теплоемкость идеального газа при адиабатном процессе равна:
а. с=0.
b. с= cp.
c. с= cv.
d. с=oo.
18. Площадь под кривой процесса на pv -диаграмме равна:
а. механической работе процесса.
b. внутренней энергии рабочего тела.
c. энтальпии рабочего тела.
d. теплоемкости рабочего тела.
19. Площадь под кривой процесса на Ts -диаграмме равна:
а. теплоте процесса.
b. энтальпии рабочего тела.
c. энтропии рабочего тела.
d. теплоемкости рабочего тела.
20. Элементарная работа расширения газа dl определяется выражением:
а. p * dv.
b. сp * dt.
c. cv * dt.
d. T * d s.
21. Теплоемкость политропного процесса меняется в пределах:
а. 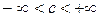 .
.
b. 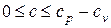
c. cv < c < cp.
d. Rг < c < 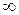 .
.
22. Теплоемкость газа при повышении температуры:
а. Увеличивается.
b. Уменьшается.
c. Остается неизменной.
d. Колеблется около некоторого среднего значения.
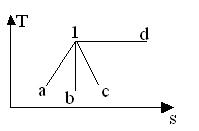 23. Л иния 1-b на Ts –диаграмме соответствует процессу:
23. Л иния 1-b на Ts –диаграмме соответствует процессу:
а. Адиабатному.
b. Изотермическому.
c. Политропному при n < k.
d. Политропному при n > k.
24. Масса идеального газа при неизменных температуре и плотности увеличивается вдвое. При этом давление газа:
а. Увеличится в 2 раза.
b. Уменьшится в 2 раза.
c. Уменьшится в 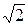 раза.
раза.
d. Не изменится.
25. Внутренняя энергия идеального газа:
а. Зависит от температуры, не зависит от объема.
b. Зависит от объема и температуры.
c. Не зависит от давления и температуры.
d. Не зависит от объема и температуры.
26. Можно судить о том, подводится теплота к рабочему телу или отводится от него по изменению величины:
а. Энтропия.
b. Удельный объем.
c. Энтальпия.
d. Температура.
27. Термодинамическая система называется изолированной, если:
а. Система не обменивается с окружающей средой любыми видами энергии.
b. Система не обменивается с окружающей средой теплотой и механической работой.
c. Система не обменивается с окружающей средой механической работой.
d. Система не обменивается с окружающей средой химической энергией и теплотой.
28. Знак работы можно определить по изменению величины:
а. Удельный объем.
b. Температура.
c. Энтропия.
d. Внутренняя энергия.
29. Содержание второго начала термодинамики соответствует соотношению:
а.d s 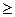 d q /T.
d q /T.
b. d s 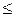 d q /T.
d q /T.
c. d s < d q /T.
d. d s = d q /T.
30. Абсолютное давление соответствует (B 0 - барометрическое давление; p изб — избыточное давление; Н 0 — разрежение.) соотношению:
а. В 0 + p изб.
b. В 0 – p изб.
c. Н 0 + p изб.
d. p изб – В0 .
31. Изменение энтальпии равно теплоте процесса:
а. Изобарный.
b. Изотермический.
c. Адиабатный.
d. Изохорный.
32. В изотермическом процессе при увеличении массы и плотности идеального газа в два раза давление:
а. Увеличится в 2 раза.
b. Уменьшится в 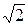 раза.
раза.
c. Уменьшится в 2 раза.
d. Не изменится.
33. В закрытом сосуде находится идеальный газ при избыточном давлении р 1 = 0,02 МПа и температуре t1 = 400 ºС. Барометрическое давление 0,1 МПа. Происходит охлаждение газа, разрежение в сосуде достигает р 2 = 0,03 МПа., при этом температура газа должна равняться:
а. 168.
b. 233.
c. 120.
d. 267.
34. Воздух с начальными температурой t1 =40°С, и объемом V1 =0,1 м3 содержится в цилиндре (диаметром цилиндра D=0,4 м) с подвижным поршнем. При нагреве воздуха до t2 =1200 C перемещение поршня (м) равно:
а. 0,21.
b. 1,59.
c. 0,11.
d. 0,85.
35. Теплоемкость идеального газа бесконечно велика в процессе:
а. Изотермический процесс.
b. Политропный процесс, n > k.
c. Адиабатный процесс.
d. Политропный процесс, n < k.
36. К идеальному газу в политропном процессе с показателем n == 2,2 подводится теплота. Этот процесс происходит при соблюдении следующих неравенств (l - работа процесса; ∆ u -изменение внутренней энергии):
а. l < 0; ∆ u > 0.
b. l > 0; ∆ u < 0
c. l > 0; ∆ u > 0
d. l < 0; ∆ u < 0.
37. Идеальный газ расширяется по политропе с показателем n ==0,7. При этом теплота процесса q и изменение внутренней энергии ∆ u соответствуют комбинации неравенств:
a. q > 0; ∆ u >0.
b. q < 0; ∆ u < 0.
c. q > 0; ∆ u <0.
d. q < 0; ∆ u > 0.
38. С ростом температуры показатель адиабаты идеального газа k= сp / сυ
(теплоемкости сp и сυ зависят от температуры):
a. Возрастает.
b. Не изменяется.
c. Убывает.
d. Однозначный ответ невозможен.
39. Для идеального газа справедливо неравенство:
а. сp > с υ >0.
b. с υ < 0 < сp.
c. сp < с υ < 0.
d. 0 < сp < с υ.
40. Связь между парциальными давлениями компонентов смеси идеальных газов и ее общим давлением устанавливается законом
а. Дальтона.
b. Авогадро.
c. Шарля.
d. Лей-Люссака.
41. Газовая постоянная смеси водорода Н2 и азота N2 равна Rсм = 900 Дж/(кг •К), массовая доля водорода в смеси:
а. 0,156.
b. 0,844.
c. 0,233.
d. 0,767.
42. Внутренняя энергия идеального газа:
а. Зависит от объема и температуры.
b. Зависит от давления, не зависит от объема.
c. Не зависит от давления и температуры.
d. Не зависит от давления и объема.
43. Разность с с — с υ изобарной и изохорной теплоемкостей для вещества, которое подчиняется уравнению состояния р (υ — b) = RТ (b = соnst) равна:
а. R.
b. pu/Т.
c. pb/Т.
d. bR/υ.
Date: 2015-05-09; view: 969; Нарушение авторских прав