
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Изменение энтропии
|
|
Изменение энтропии можно представить как:
dS = deS + diS, (8.57)
где deS - изменение энтропии системы за счет обмена энергией и веществом с внешней средой; diS - изменение энтропии вследствие необратимых процессов, происходящих в системе.
Для замкнутой системы, в которой отсутствует обмен веществом, deS = 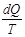 , причем величина deS может быть положительной или отрицательной, а величина diS может быть только больше нуля или равняться нулю. Во время кругового процесса, когда система возвращается в исходное состояние, суммарное изменение энтропии равно нулю, то-есть:
, причем величина deS может быть положительной или отрицательной, а величина diS может быть только больше нуля или равняться нулю. Во время кругового процесса, когда система возвращается в исходное состояние, суммарное изменение энтропии равно нулю, то-есть:
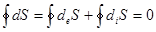 . (8.58)
. (8.58)
Поскольку diS³ 0, выходит, что 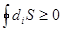 . То-есть, для замкнутой системы с учетом уравнения (8.58) получим выражение:
. То-есть, для замкнутой системы с учетом уравнения (8.58) получим выражение:
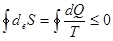 . (8.59)
. (8.59)
Итак, в природе отсутствуют такие реальные системы, которые могли бы пройти серию термодинамических процессов и возвратиться в начальное состояние без возрастания энтропии.
Для изолированной системы, которая не обменивается с окружающей средой ни энергиею, ни веществом, имеют место такие соотношения:
deS = 0 и dіS ³ 0. (8.60)
Для замкнутой системы, обменивающейся с окружающей средой энергией, обмен веществом отсутствует, так что можно записать:
deS = 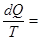 (dU +pdV)/ T и dіS ³ 0. (8.61)
(dU +pdV)/ T и dіS ³ 0. (8.61)
Для открытой системы, в которой происходит обмен с окружающей средой энергиею и веществом. справедливы такие соотношения:
deS = (dU +pdV)/T + dSвещ и dіS ³ 0, (8.62)
где dSвеч - изменение энтропии за счет потока вещества.
Следует отметить, что для открытой системы dU +pdV ¹ dQ.
Таким образом, для любой термодинамической системы (изолированной, замкнутой или открытой) имеет место соотношение dіS³ 0.
Для замкнутой системы обмен веществом отсутствует, в результате чего deS = dQ / T. Величина deS может быть положительной или отрицательной. Энтропия благодаря взаимодействию с окружающей средой может увеличиваться (dеS > 0) или уменьшаться (dеS < 0). Что касается величины dіS, то она может быть или больше нуля, или равняться нулю (dіS³ 0).
Если в системе осуществляются обратимые процессы, то изменение энтропии равно нулю (dіS = 0). Реальные системы характеризуются протеканием необратимых процессов, вследствие чего происходит положительное изменение энтропии (dіS > 0).
Стационарным состоянием с точки зрения энтропии называется такое состояние системы, при котором энтропия S всей открытой системы сохраняется, то-есть полное изменение энтропии равно нулю (dS = 0).
Из уравнения (8.13) выходит, что deS + dіS = 0, или deS = -dіS. Поскольку dіS > 0, изменение энтропии dеS за счет взаимодействия с окружением должна быть отрицательной (dеS < 0) и равной по модулю dіS. Это условие выполняется, если энтропия, производимая внутри системы, полностью рассеивается в окружение. Можно, таким образом, утверждать, что открытые системы в стационарном состоянии питаются негэнтропией (отрицательной энтропией).
Date: 2015-05-09; view: 881; Нарушение авторских прав