
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Распределение Максвелла. Полученная ранее барометрическая формула обязана своим видом тому, что скорости молекул не одинаковы
|
|
Полученная ранее барометрическая формула обязана своим видом тому, что скорости молекул не одинаковы, а распределены определенным образом. Характер этого распределения и определяет вид зависимости плотности молекул от высоты.
n= n0е(-mg/kT)x
Пользуясь этой формулой можно найти вид функции распределения молекул по скорости.
Возьмем сосуд с газом в пустом пространстве в поле сил тяжести. Газ находится в состоянии равновесия и его молекулы каким-то образом распределены по скорости. Сила тяжести действует на Z компоненту скорости (по вертикали), поэтому найдем распределение молекул по значению составляющей скорости vz. Движение вверх вдоль оси Z сопровождается уменьшением Z компоненты скорости. Если на начальной высоте Z0 скорость равна vz0, то на высоте Z значение vz можно найти из закона сохранения энергии:
m(vz0)2/2= m(vz0)2/2+mgZ (*)
Молекулы с энергией m(vz0)2/2≤mgZ не могут подняться выше Z=(vz0)2/2g, они после подъема до Z падают вниз c ускорением.
 Выделим на высоте Z слой dZ с площадью S=1м2. Газ в слое состоит из движущихся вверх и вниз молекул (нас интересуют молекулы вдоль оси Z). Разница между молекулами снизу и сверху состоит в том, что молекулы, приходящие снизу, имеют Z-компоненту скорости с v≥√2gZ, в то время, как молекулы, приходящие сверху, могут иметь Z-компоненту с любыми скоростями от 0 до ∞.
Выделим на высоте Z слой dZ с площадью S=1м2. Газ в слое состоит из движущихся вверх и вниз молекул (нас интересуют молекулы вдоль оси Z). Разница между молекулами снизу и сверху состоит в том, что молекулы, приходящие снизу, имеют Z-компоненту скорости с v≥√2gZ, в то время, как молекулы, приходящие сверху, могут иметь Z-компоненту с любыми скоростями от 0 до ∞.
В условиях равновесия число молекул в слое должно быть постоянно, число молекул, проходящих сверху вниз, должно быть равно числу молекул, проходящих снизу вверх. На высоте Z0 число молекул в единице объема с Z компонентой скорости, лежащей в интервале от vz0 до vz0+dvz0 определяется выражением: dnz0= nz0f(vz0)dvz0
|
|

 N↑=∫nz0vz0f(vz0)dvz0= nz0∫vz0f(vz0)dvz0
N↑=∫nz0vz0f(vz0)dvz0= nz0∫vz0f(vz0)dvz0
|
|
|
|
 Получим: ∫f(vz0)vz0dvz0= е(-mg/kT)z ∫ f(vz)vzdvz
Получим: ∫f(vz0)vz0dvz0= е(-mg/kT)z ∫ f(vz)vzdvz
|
|
∫f(vz0)vzdvz=e-∫f(vz)vzdvz
 заменили предел интегрирования т. к. vZ изм. от 0 до µ
заменили предел интегрирования т. к. vZ изм. от 0 до µ
то есть f(vz)=f(vz0)е(-mg/kT)z (**)
Сравнивая это с законом сохранения энергии (*) можно убедится, что функции f(v) должны иметь вид:
f(vz)=Ае и f(vz0)=Ae[D1]
Значит f(vz)=Ае
Число молекул в единице объема, с Z компонентой скорости, лежащей в интервале от vZ до vZ+ dvZ выражается формулой
dn=nAe dvZ; a dn/n=Ae dvz –
|
|
Постоянная А находится из усл. нормировки ∫ dn/n=A∫ e- dvz=1
|



|
 Вводится переменная х2 = m(vz)2/2kT => vZ = √2kT/m x => dvz = √ dx
Вводится переменная х2 = m(vz)2/2kT => vZ = √2kT/m x => dvz = √ dx
Интеграл сводится к ∫ e-х dx = √ π и тогда A = √m/2πkT
И формула распределения принимает вид: f(vz) = dn/ndvZ = (m/2πkT)1/2×e[D2]
f(vZ)→0 при vZ→∞
Видно,что доля молекул с Z-компонентой скорости равной 0 не равна 0, она равна А и с повышением Т уменьшается.
Мы получили распределение молекул по Z- составляющей скорости в поле сил тяжести, но это не означает, что распределение связано с действием силы тяжести. И что mg создает это распределение. Сама барометрическая формула является следствием распределения молекул по скорости. Сила тяжести лишь «проявила» существование в газе распределения, поэтому в f(v) сила тяжести не входит (нет g).
Очевидно, что совершенно такие же распределения должны быть и по другим компонентам скорости:
dn/ndvx = Ae[D3]
dn/ndvy = Ae[D4]
Теперь нужно найти вероятность того, что скорости молекул удовлетворяют трем условиям:
vx лежит в пределах от vx до vx+dvx , vy лежит в пределах от vy до vy+dvy , а vz лежит в пределах от vz до vz+dvz. Значения составляющих скоростей молекул по каждой из осей координат не зависят от значений по другим осям. Поэтому, вероятность того, что скорость молекулы одновременно удовлетворяет трем условиям является «вероятностью сложного события», т.е. равна произведению вероятностей.
Если обозначить число молекул в единице объема газа dnxyz с составляющими по осям dnx, dny, dnz,то
dnxyz/n = A3e[D5] dvxdvydvz v2 = Σ(vi)2
Эта формула показывает, сколько молекул из числа находящихся в единице объема обладают скоростями, составляющие которых по осям координат лежат в интервале между vx и vx+dvx, vy и vy+dvy, vz и vz+dvz, т.е. обладают скоростью, лежащей в интервале заданном и по величине и по направлению. В распределении необходимо учесть все любые направления движения.
Если собрать все молекулы единицы объема газа со скоростями в интервале от v до v+dv по всем любым направлениям и выпустить их, то они, разлетаясь по всем направлениям, через 1 с окажутся равномерно распределенными в шаровом слое радиусом v и толщиной dv. Число молекул в единице объема этого слоя (объем скоростей) такое же, как и в параллелепипеде объемом dvxdvydvz. Число же молекул во всем слое – это и есть число молекул в единице объема газа, независимо от направления, скорости которых лежат в интервале от v до v+dv:
dn = n(m/2πkT)3/2e[D6] dΩ; dΩ = 4πv2dv, отсюда:
 dn/n =(4/√π)(m/2kT) 3/2 v2
dn/n =(4/√π)(m/2kT) 3/2 v2 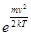 dv
dv
Это и есть закон Максвелла распределения молекул по скоростям.
dn/n – вероятность того, что у произвольно выбранной молекулы газа скорость окажется лежащей в интервале от v до v+dv, Другими словами, это доля всех молекул ед. объема, скорости кот. лежат в интервале от v до v+ dv. Величина
f(v) = dn/ndv = (4/√  π)(m/2kT) 3/2 v2 e[D7] dv – функция распределения молекул по скоростям.
π)(m/2kT) 3/2 v2 e[D7] dv – функция распределения молекул по скоростям.
Она определяет долю молекул в единице объема, скорости которых заключены в единичном интервале скоростей вблизи v, включающем данную скорость.
f(v) обращается в 0 при v = 0 и v = ∞, т.е., нет неподвижных молекул и нет молекул с бесконечно большой скоростью. Имеется максимум при vн, т.е. наибольшая часть молекул движется со скоростью v ≈ vн, т.е. вероятность того, что молекула имеет скорость vн – наибольшая, поэтому vн называют наиболее вероятной скоростью.
Пользуясь кривой распределения молекул по скоростям можно графически найти долю молекул dn/n в единице объема газа, скорости которых лежат в заданном интервале скоростей dv. Графически - это площадь с основанием dv и высотой f(v). Вся площадь под кривой f(v) соответствует общему числу молекул в единице объема.
Вид кривой зависит от природы газа и от Т. С повышением Т максимум смещается в сторону больших скоростей, но площадь под кривой остается постоянной, т.к. n = const.
При выводе распред. Максвелла по скоростям совершенно не принимали во внимание столкновения молекул между собой, хотя они изменяют скорость и влияют на распределение. В действительности именно благодаря столкновениям и устанавливается максвелловское распределение по скоростям. При каждом столкновении скорость одной молекулы увеличивается, другой уменьшается. Максвелл предположил, что равновесному состоянию отвечает такое, при котором число молекул, скорости которых увеличиваются при столкновении равно числу молекул, скорости которых уменьшаются при столкновениях. Такому состоянию и соответствует распределение Максвелла.
Позже Больцман показал, что если газ находится в состоянии с немаксвелловским распределением, то благодаря столкновениям он сам собой переходит в состояние с максвелловским распределением.
Распределение Максвелла (иногда говорят Максвелла -Больцмана) – это равновесное распределение. Теперь можно дать определение хаотичному движению: движение молекул полностью хаотично, если скорости распределены по закону Максвелла.
Date: 2015-05-09; view: 856; Нарушение авторских прав