
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Изопроцессы идеального газа
|
|
Уравнение первого закона термодинамики можно записать для равновесных процессов изменения его состояния в ином виде, используя выражения для теплоемкости однородного тела, откуда 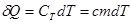 или с учетом молярной теплоемкости:
или с учетом молярной теплоемкости: 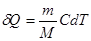 , а для одного моля
, а для одного моля 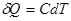 .
.
Тогда первый закон можно записать в виде:
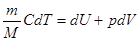
Применим его к различным изопроцессам идеального газа.
1. Изохорный процесс, 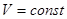 .(закон Шарля).
.(закон Шарля).
На диаграмме 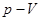 это вертикальная прямая: 1 – 2 нагрев, а 1 - 3 охлаждение. Практически этот процесс проводят, изменяя температуру газа, находящегося в толстостенном сосуде с неизменным объемом. В этом процессе работа не совершается:
это вертикальная прямая: 1 – 2 нагрев, а 1 - 3 охлаждение. Практически этот процесс проводят, изменяя температуру газа, находящегося в толстостенном сосуде с неизменным объемом. В этом процессе работа не совершается: 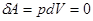 . Вся теплота идет на изменение его внутренней энергии.
. Вся теплота идет на изменение его внутренней энергии. 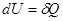 ,
,
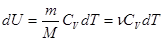 (1), где
(1), где 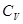 - молярная теплоемкость при постоянном объеме. Из опытов известно, что
- молярная теплоемкость при постоянном объеме. Из опытов известно, что 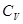 зависит от химического состава газа и его Т. Для не очень широкой области температур можно считать, что
зависит от химического состава газа и его Т. Для не очень широкой области температур можно считать, что 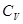 =const.
=const.
При изохорном конечном нагреве газа от температуры Т1 до температуры Т2 изменение внутренней энергии равно
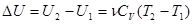 (2), и теплота, сообщенная системе:
(2), и теплота, сообщенная системе:
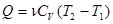 (3)
(3)
Для идеального газа внутренняя энергия это энергия теплового движения молекул, непосредственно не зависящая от объема (расстояния между молекулами), как в реальных газах. При расширении и сжатии газа его 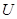 будет изменяться только за счет изменения кинетической энергии теплового движения, т.е., за счет температуры. Таким образом, соотношения (1) и (2) справедливы для любого процесса изменения состояния идеального газа, а не только изохорного. Внутренняя энергия газа зависит только от его массы, химического состава и температуры. Это подтверждается опытами Гей – Люссака и Джоуля.
будет изменяться только за счет изменения кинетической энергии теплового движения, т.е., за счет температуры. Таким образом, соотношения (1) и (2) справедливы для любого процесса изменения состояния идеального газа, а не только изохорного. Внутренняя энергия газа зависит только от его массы, химического состава и температуры. Это подтверждается опытами Гей – Люссака и Джоуля.
Значит, для любого равновесного процесса изменения состояния идеального газа уравнение первого закона термодинамики имеет вид:
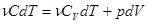 (4)
(4)
2. Изобарный процесс, 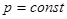 . (Закон Гей -Люссака)
. (Закон Гей -Люссака)
Он реализуется при нагревании газа в цилиндре с подвижным поршнем, на который действует постоянное внешнее давление.
На рис. изображены процессы изобарного расширения газа при его нагревании (1-2) и изобарного сжатия при его охлаждении (2-3).
Элементарная теплота, сообщенная газу в изобарном процессе:
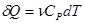 (5), где
(5), где 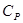 - молярная теплоемкость при постоянном давлении.
- молярная теплоемкость при постоянном давлении.
Элементарная работа, совершенная идеальным газом при этом:
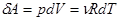 (6), учитывая уравнение Менделеева –Клапейрона.
(6), учитывая уравнение Менделеева –Клапейрона.
Из последнего уравнения можно выяснить смысл 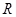 :
:
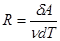 , т.е. универсальная газовая постоянная численно равна работе, совершенной одним молем идеального газа при его изобарном нагревании на 1К.
, т.е. универсальная газовая постоянная численно равна работе, совершенной одним молем идеального газа при его изобарном нагревании на 1К.
Подставим в первый закон выражения для 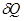 и
и 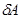 и найдем связь между
и найдем связь между 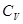 и
и 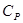 :
:
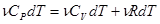 , откуда:
, откуда: 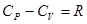 (7) – уравнение Майера для молярных теплоемкостей. Отсюда видно, что при изобарном нагревании газа к нему должна быть подведена большая теплота, чем для такого же изохорного нагревания, разность их равна работе, совершенной газом при изобарном расширении.
(7) – уравнение Майера для молярных теплоемкостей. Отсюда видно, что при изобарном нагревании газа к нему должна быть подведена большая теплота, чем для такого же изохорного нагревания, разность их равна работе, совершенной газом при изобарном расширении.
Работа газа при изобарном расширении при переходе из состояния 1 в состояние 2, рис.
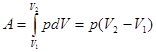 (8).
(8).
Если 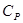 постоянная, то теплота, сообщенная газу в изобарном процессе:
постоянная, то теплота, сообщенная газу в изобарном процессе:
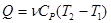 (9), а изменение внутренней энергии в процессе:
(9), а изменение внутренней энергии в процессе:
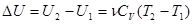 (10).
(10).
3. Изотермический процесс, Т=const. (закон Бойля – Мариотта)
Может происходить в условиях, когда теплообмен между газом и внешней средой осуществляется при постоянной (конечной) разности температур. Для этого теплоемкость внешней среды должна быть велика и процесс расширения или сжатия должен идти весьма медленно (для квазиравновесия). Изотермическими являются процессы кипения, конденсации, плавления и кристаллизации химически чистых веществ, происходящих при постоянном давлении.
Для идеального газа в этом процессе выполняется закон Бойля – Мариотта: 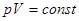 , графиком которого является гипербола, рис.. Внутренняя энергия газа постоянна в процессе, значит:
, графиком которого является гипербола, рис.. Внутренняя энергия газа постоянна в процессе, значит:
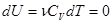 (11), а
(11), а 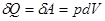 ,
,
т.е., вся теплота, сообщенная системе, идет на совершение газом работы против внешних сил:
 (12)
(12)
При изотермическом расширении 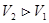 , к нему подводится теплота
, к нему подводится теплота 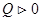 , газ совершает положительную работу,
, газ совершает положительную работу, 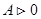 , рис., процесс 1-2. При сжатии газа, процесс 1-3, работа, совершенная газом отрицательна, положительную работу при этом выполняют внешние силы, От газа отводится теплота
, рис., процесс 1-2. При сжатии газа, процесс 1-3, работа, совершенная газом отрицательна, положительную работу при этом выполняют внешние силы, От газа отводится теплота 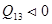 .
.
Теплоемкость газа в изотермическом процессе 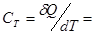 ± µ, т.к.,
± µ, т.к., 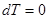 .
.
3. Адиабатный процесс, 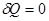 .
.
Это процесс, при котором система не обменивается теплотой с окружающей средой. Практически процесс производят при достаточно быстром расширении или сжатии газа.
Тогда из первого закона следует:
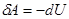 - система совершает работу за счет убыли внутренней энергии. Или, записывая более подробно, получим:
- система совершает работу за счет убыли внутренней энергии. Или, записывая более подробно, получим:
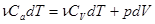 (13)
(13)
Здесь теплоемкость при адиабатном процессе - 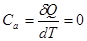 , т.к.,
, т.к., 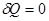 .
.
Из (13) видно, что 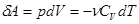 (14)
(14)
При расширении 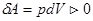 и
и 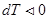 , газ охлаждается, при адиабатном сжатии
, газ охлаждается, при адиабатном сжатии 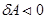 и
и  , газ нагревается.
, газ нагревается.
Связь между параметрами состояния адиабатного процесса можно найти, взяв дифференциалы от 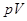 и от уравнения Менделеева - Клапейрона:
и от уравнения Менделеева - Клапейрона:
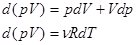 (15), отсюда можно выразить
(15), отсюда можно выразить 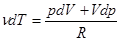 , подставить в уравнение (14) и получить:
, подставить в уравнение (14) и получить: 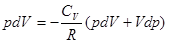 . Заменив здесь
. Заменив здесь 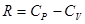 из уравнения Майера, получим после простых преобразований:
из уравнения Майера, получим после простых преобразований:
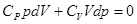 , далее разделим переменные, поделив уравнение на
, далее разделим переменные, поделив уравнение на 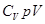 и обозначим
и обозначим  - показатель адиабаты или постоянная Пуассона.
- показатель адиабаты или постоянная Пуассона.
Тогда 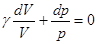 . После интегрирования
. После интегрирования 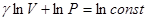 или:
или:
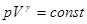
Это есть уравнение адиабаты или уравнение Пуассона. С помощью уравнения Менделеева – Клапейрона его можно записать через другие параметры:
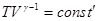 или
или 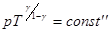 .
.
Из рис. видно, что адиабата идет круче, чем изотерма, поскольку 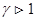 для любого идеального газа. Это объясняется тем, что при адиабатном сжатии увеличение давления происходит не только из-за уменьшения объема, как в изотермическом процессе, но и из-за возрастания температуры. При адиабатном расширении газа его температура уменьшается и давление падает сильнее, чем при соответствующем изотермическом расширении.
для любого идеального газа. Это объясняется тем, что при адиабатном сжатии увеличение давления происходит не только из-за уменьшения объема, как в изотермическом процессе, но и из-за возрастания температуры. При адиабатном расширении газа его температура уменьшается и давление падает сильнее, чем при соответствующем изотермическом расширении.
Работа в адиабатном (конечном) процессе 1-2 (на рис. площадь под кривой)
Date: 2015-05-09; view: 1008; Нарушение авторских прав