
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Примеры решения задач. Задача 1. Рассчитайте стандартную энтальпию образования газообразного бутана C4H10, если при его сгорании образовались 224 л (н.у.) оксида углерода CO2(г)
Задача 1. Рассчитайте стандартную энтальпию образования газообразного бутана C4H10, если при его сгорании образовались 224 л (н.у.) оксида углерода CO2(г), газообразная вода и выделилось 6647 кДж теплоты. Стандартные энтальпии образования  (CO2(г)) и
(CO2(г)) и  (H2O(г)) известны.
(H2O(г)) известны.
Решение. Запишем уравнение реакции горения бутана и расставим стехиометрические коэффициенты:
C4H10 (г)+ 6,5О2 (г) = 4CO2 (г) + 5H2O(г).
При такой записи уравнения тепловой эффект реакции относится на 1 моль C4H10.
Запишем выражение для расчета теплового эффекта реакции:
 = 4
= 4  (CO2(г)) + 5
(CO2(г)) + 5  (H2O(г)) -
(H2O(г)) -  (C4H10(г)).
(C4H10(г)).
Стандартная энтальпия образования О2 (г) равна нулю. Величины  (CO2(г)) и
(CO2(г)) и  (H2O(г)) берем из справочной таблицы. Искомой величиной является
(H2O(г)) берем из справочной таблицы. Искомой величиной является  (C4H10(г)). Выразим уравнение относительно искомой величины:
(C4H10(г)). Выразим уравнение относительно искомой величины:
 (C4H10(г)) = 4
(C4H10(г)) = 4  (CO2(г)) + 5
(CO2(г)) + 5  (H2O(г)) -
(H2O(г)) -  .
.
Теперь необходимо найти величину  из условия задачи.
из условия задачи.
Рассчитаем количество вещества оксида углерода:
n(CO2) = VО(CO2)/ VОм = 224/22,4 = 10 моль..
Воспользуемся пропорцией (5) и найдем тепловой эффект записанной нами реакции:
 =
= 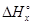 × n(CO2) / n(CO2) = (-6647) × 4/10 = -2659 кДж.
× n(CO2) / n(CO2) = (-6647) × 4/10 = -2659 кДж.
Теперь подставим данные в записанное нами ранее выражение:
 (C4H10) = 4(-393,5) +5(-241,8) –(-2659) = -124 кДж/моль.
(C4H10) = 4(-393,5) +5(-241,8) –(-2659) = -124 кДж/моль.
Ответ.  (C4H10(г)) = -124 кДж/моль.
(C4H10(г)) = -124 кДж/моль.
Задача 2. При взаимодействии 508 г йода по реакции:
H2 (г) + I2 (г) = 2HI(г)
выделилось 20,4 кДж теплоты. Рассчитайте стандартную энтальпию образования йодистого водорода, если известна энтальпия сублимации йода 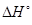 субл(I2) = 62 кДж/моль.
субл(I2) = 62 кДж/моль.
Решение. Запишем выражение для расчета теплового эффекта реакции:
 = 2
= 2  (HI(г)) -
(HI(г)) -  (H2(г)) -
(H2(г)) -  (I2 (г)).
(I2 (г)).
Искомой величиной является  (HI(г)). Стандартная энтальпия образования водорода
(HI(г)). Стандартная энтальпия образования водорода  (H2(г))=0, т.к. это простое вещество в стандартном состоянии. Для йода за стандартное принято твердое состояние, а не газообразное. Но нам известна энтальпия сублимации йода, т.е тепловой эффект процесса:
(H2(г))=0, т.к. это простое вещество в стандартном состоянии. Для йода за стандартное принято твердое состояние, а не газообразное. Но нам известна энтальпия сублимации йода, т.е тепловой эффект процесса:
I2 (тв) = I2 (г),  =
= 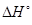 субл(I2) =
субл(I2) =  (I2 (г)) = 62 кДж/моль.
(I2 (г)) = 62 кДж/моль.
Для расчета энтальпии образования HI необходимо знать тепловой эффект реакции  , в которой он образуется.
, в которой он образуется.
Рассчитаем количество молей вступившего в реакцию йода:
n(I2) = m(I2)/ M(I2) = 508/254 = 2 моль.
Составим пропорцию:
по уравнению на n(I2) моль ® выделяется  кДж,
кДж,
по условию на n(I2) моль ® выделяется 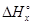 кДж.
кДж.
 =
= 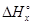 × n(I2) / n(I2) = (-20,4) × 1/ 2 = -10,2 кДж.
× n(I2) / n(I2) = (-20,4) × 1/ 2 = -10,2 кДж.
Теперь можно найти искомую величину из выражения для расчета теплового эффекта реакции:
 (HI(г)) = (
(HI(г)) = ( +
+  (I2(г)))/n(HI(г)) = (-10,2 + 62) / 2 = = 25,9 кДж/моль.
(I2(г)))/n(HI(г)) = (-10,2 + 62) / 2 = = 25,9 кДж/моль.
Ответ.  (HI(Г)) = 25,9 кДж/моль.
(HI(Г)) = 25,9 кДж/моль.
Задача 3. Определите тепловой эффект  реакции
реакции
Fe2O3 (тв) + FeO(тв) = Fe3O4 (тв),
используя следующие данные:
3 Fe2O3 (тв) + H2 (г) = 2 Fe3O4 (тв) + H2O(г)  (1) = -13,3 кДж,
(1) = -13,3 кДж,
Fe3O 4(тв) + H2 (г) = 3 FeO (тв) + H2O(г)  (2) = -84,8 кДж.
(2) = -84,8 кДж.
Решение. Решение заключается в построении такой алгебраической суммы данных термохимических уравнений реакций, которая соответствует искомому уравнению реакции. Разделим оба уравнения на 3 (или умножим на 1/3), тем самым приведем к одному молю каждого из оксидов Fe2O3 и FeO, как в искомом уравнении. Вычтем из первого уравнения второе и получим искомое:
1/3 ç 3 Fe2O3 (Т) + H2 (Г) = 2 Fe3O4 (Т) + H2O(Г)  (1)
(1)
- 
1/3 ½ Fe3O4 (Т) + H2 (Г) = 3 FeO(Т) + H2O(Г)  (2)
(2)
Fe2O3 (Т) + FeO(Т) = Fe3O4(Т)  (3)
(3)
Внимание, при переносе формульной единицы из одной части уравнения в другую знак перед ней, естественно, меняется.
Тогда тепловой эффект  (3) тоже равен алгебраической сумме заданных тепловых эффектов:
(3) тоже равен алгебраической сумме заданных тепловых эффектов:
 (3) = 1/3(
(3) = 1/3( (1) -
(1) -  (2)) =1/3(-13.3 –84,8) = -32.7 кДж.
(2)) =1/3(-13.3 –84,8) = -32.7 кДж.
Ответ. Тепловой эффект реакции  (3) = -32.7 кДж.
(3) = -32.7 кДж.
Задача 4. Определите стандартную энтальпию образования сульфата цинка  (ZnSO4(тв)) по следующим данным:
(ZnSO4(тв)) по следующим данным:
2ZnS(тв) + 3O2 (г) = 2ZnO(тв) + 2SO2 (г)  = -927 кДж,
= -927 кДж,
ZnSO4 (тв) = ZnO(тв) + SO3 (г)  = 230 кДж,
= 230 кДж,
ZnS(тв) = Zn(тв) + S(тв)  = 184 кДж,
= 184 кДж,
2SO2 (г) + O2 (г) = 2SO3 (г)  = -198 кДж.
= -198 кДж.
Решение. Определить  ZnSO4) – значит надо рассчитать тепловой эффект такой реакции, в которой 1 моль этого вещества образуется из простых веществ в их стандартном состоянии (Zn(тв), S(тв), O2(г)). Для этого, как и в предыдущей задаче, скомбинируем заданные уравнения реакций таким образом, чтобы в итоге получилось искомое уравнение.
ZnSO4) – значит надо рассчитать тепловой эффект такой реакции, в которой 1 моль этого вещества образуется из простых веществ в их стандартном состоянии (Zn(тв), S(тв), O2(г)). Для этого, как и в предыдущей задаче, скомбинируем заданные уравнения реакций таким образом, чтобы в итоге получилось искомое уравнение.
1/2 ½2ZnS(тв) + 3O2 (г) = 2ZnO(тв) + 2SO2 (г)  (1) = -927 кДж,
(1) = -927 кДж,
-
1 ½ ZnSO4 (тв) = ZnO(тв) + SO3 (г)  (2)= 230 кДж,
(2)= 230 кДж,
-
1 ½ ZnS(тв) = Zn(тв) + S(тв)  (3)= 189 кДж,
(3)= 189 кДж,
+
1/2 ½ 2SO2 (г) + O2 (г) = 2SO3 (г)  (4) = -198 кДж.
(4) = -198 кДж.
Zn(тв) + S(тв) + 2O2 (г) = ZnSO4 (тв)  (5) =
(5) =  (ZnSO4(тв)) =?
(ZnSO4(тв)) =?
Тогда искомая энтальпия образования ZnSO4 равна алгебраической сумме заданных тепловых эффектов:
 (ZnSO4) = 1/2
(ZnSO4) = 1/2  (1) -
(1) -  (2) -
(2) -  (3) – 1/2
(3) – 1/2  (4) = = 1/2(-927) - 230 - 189 - 1/2(-198) = -981,5 кДж/моль.
(4) = = 1/2(-927) - 230 - 189 - 1/2(-198) = -981,5 кДж/моль.
Ответ.  (ZnSO4) = -981,5 кДж/моль.
(ZnSO4) = -981,5 кДж/моль.
IV. ИЗМЕНЕНИЕ ЭНТРОПИИ РЕАКЦИИ
Date: 2015-05-09; view: 1324; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |