
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Молярная теплоемкость (С) - количество теплоты, получаемое одним молем вещества при нагревании его на один кельвин
|
|
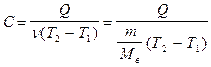 ;
; 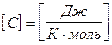
Зная теплоемкость вещества в данном термодинамическом процессе, легко найти полученное телом количество теплоты:
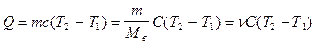
Теплоемкость определяется не только свойствами вещества, но и видом термодинамического процесса.
1. Изотермический процесс. При изотермическом расширении (Т = пост.) газа к нему подводится тепло (Q>0), но его температура остается неизменной. Из определения следует, что теплоемкость газа в изотермическом процессе бесконечно велика. В этом случае все переданное системе количество теплоты идет на совершение работы.
2. Адиабатный процесс. Если газ участвует в адиабатном процессе, то его температура изменяется, а полученное газом количество теплоты равно нулю. Следовательно, в адиабатных процессах теплоемкость равна нулю, и работа газа А' над внешними телами совершается за счет убыли внутренней энергии: А ' = -ΔU.
3. Процессы, при которых теплоемкость остается неизменной, принято называть политропическими. Примерами политропических процессов, наряду о изотермическим и адиабатным, являются также изохорный (V = пост.) и изобарный (Р = пост.) процессы. Соответствующие им молярные теплоемкости обозначают через СV и Ср.
4. Изохорный процесс. При изохорном процессе А = 0 и Q = ΔU
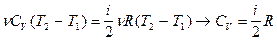
5. Изобарный процесс. При изобарном процессе (Р = пост.) газ при нагревании расширяется и совершает работу. Полученное газом тепло лишь частично идет на увеличение внутренней энергии, остальная часть затрачивается на совершение работы по расширению. Ясно, что для повышения температуры газа на один кельвин необходимо передать газу большее количество теплоты, чем при изохорном процессе, следовательно, Ср > СV.
Q = ΔU+A' → νCp(T2 – Т1) = νCv(T2 – Т1) + νR(T2 – T1);
Ср = Сv + R – уравнение Роберта Майера.
| , |
IV. Задачи:
1. При нагревании 1 кг неизвестного газа на 1 К при постоянном давлении требуется 908,6 Дж, а при нагревании при постоянном объеме требуется 649 Дж. Что это за газ? (i = 5, Мв = 0,032 кг/моль).
2. В цилиндре, закрытом поршнем массой 1 кг и сечением 10 см2 находится 14 г азота при температуре 270С и давлении 1,1 атм. Какова сила трения между поршнем и стенками цилиндра, если для того, чтобы сдвинуть поршень, газу сообщили количество теплоты 150 кал? Атмосферное давление равно 1 атм, а молярная теплоемкость азота при постоянном объеме 5 кал/(К∙моль).
3. Равные массы гелия и водорода находятся в теплоизолированном цилиндре под поршнем. Начальный объем смеси 1 л, давление 9 атм. При адиабатическом расширении газ совершает работу 650 Дж. Найти относительное изменение температуры смеси.
4. Один моль идеального газа находится при температуре 300 К. Его объем увеличивают в 5 раз так, что теплоемкость газа в этом процессе остается постоянной и равной 5000 Дж/К. Оцените, на сколько изменится температура газа (процесс расширения близок к изотермическому процессу).
5. Идеальный одноатомный газ расширяется с линейной зависимостью давления от объема 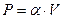 , где
, где 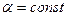 . Найти молярную теплоемкость газа в этом процессе.
. Найти молярную теплоемкость газа в этом процессе.
Вопросы:
1. Может ли теплоемкость газа на участке процесса быть отрицательной и что при этом с газом происходит?
2. Почему теплоемкость двухатомных газов больше теплоемкости одноатомных газов?
3. Какова теплоемкость газа в изотермическом процессе и адиабатном процессе?
4. Какой газ имеет наибольшую удельную теплоемкость?
5. Принцип Анри ле Шателье утверждает: "Внешнее воздействие, выводящее систему из термодинамического равновесия, вызывает в ней процессы, стремящиеся ослабить результаты этого воздействия". Приведите примеры.
"Самое красивое важное достояние этой теории
(термодинамики) – это понимание термодинамической “необратимости”,
как картины перехода к более вероятным состояниям".
 В. Паули
В. Паули
Урок 7. ВТОРОЙ ЗАКОН ТЕРМОДИНАМИКИ
ЦЕЛЬ УРОКА: Дать формулировки второго закона термодинамики и его статистическую интерпретацию; научить применять закон в конкретных ситуациях.
ТИП УРОКА: Комбинированный.
ОБОРУДОВАНИЕ: Нитяной маятник, калориметр, тела для калориметра, электроплитка, термометр электрический, ящик с белыми и черными шариками, коробок со спичками, диафильм “Необратимость тепловых процессов”.
ПЛАН УРОКА:
1. Вступительная часть 1-2 мин
2. Опрос 10 мин
3. Объяснение 25 мин
4. Задание на дом 2-3 мин
II. Вопросы:
1. Для получения газированной воды через воду пропускают сжатый углекислый газ. Почему температура воды при этом понижается?
2. Почему нагревается велосипедный насос при накачивании им воздуха в шину?
3. Изобразите изопроцессы графически в координатах Q,A′; Q,ΔU; A,′ΔU.
4. Почему проколотый мячик не отскакивает при ударе им о пол?
5. При изобарном нагревании газообразный гелий получил количество теплоты 100 Дж. Каково изменение внутренней энергии гелия?
6. Перед вами пять законов: Q = ΔU + А', А′ = -ΔU, Q = ΔU, А + Q = ΔU, А = ΔU. Какой из законов надо применять для объяснения данного явления?
а) Нагревание насоса при накачивании велосипедного колеса;
б) Образование снежка при сжатии снега руками;
в) Образование облаков при подъеме теплого влажного воздуха вверх;
г) Нагревание сосуда с водой на электроплитке;
д) Просветление венозной крови у людей в тропиках.
6. Идеальный газ может переходить из одного состояния в другое двумя способами: первый раз сначала по изобаре, затем по изохоре, второй раз наоборот. При каком переходе выделяется (поглощается) больше тепла?
Задачи׃
1. Какое количество теплоты получил 1 моль идеального одноатомного газа при изобарном нагревании от некоторой начальной температуры и последующем адиабатном расширении, если при адиабатном расширении газ совершил работу 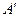 , а в конечном состоянии его температура равна начальной. Построить график процесса.
, а в конечном состоянии его температура равна начальной. Построить график процесса.
2. Одноатомный идеальный газ в количестве ν = 5 моль сначала охлаждают при постоянном объеме от температуры 600 К до температуры 400 К, а затем продолжают охлаждать при постоянном давлении до температуры 300 К. Какое количество теплоты отводят при этом от газа? Построить график процесса.
3.  Астронавты, исследуя воздух открытой ими планеты, нагрели порцию воздуха массой 200 г на 600С один раз при постоянном давлении, а другой – при постоянном объеме. Оказалось, что при постоянном давлении требуется подвести на 1 кДж больше тепла, чем при постоянном объеме. Найдите молярную массу воздуха, считая его идеальным газом.
Астронавты, исследуя воздух открытой ими планеты, нагрели порцию воздуха массой 200 г на 600С один раз при постоянном давлении, а другой – при постоянном объеме. Оказалось, что при постоянном давлении требуется подвести на 1 кДж больше тепла, чем при постоянном объеме. Найдите молярную массу воздуха, считая его идеальным газом.
III. ФИЗИКА И СУД! В пивоварне охлаждали один из отдаленных погребов посредством центральной холодильной установки. Трубопровод с рассолом проложили через погреб одного торговца. Вскоре, владелец пивоварни обнаружил, что торговец использует рассол для охлаждения своего погреба, и обвинил его в краже. Однако судья заявил: “В соответствии со статьей 242 УК, кража есть противозаконное присвоение чужого имущества. В данном случае нет состава преступления, т.к. торговец не присваивал себе рассол”.
Тогда владелец пивоварни обратился в следующую инстанцию, аргументируя свою точку зрения: “Речь идет не о краже рассола, а о краже энергии. Если я буду охлаждать погреб торговца, я должен потреблять больше энергии для холодильной машины”. Возражение нового, судьи физически было обосновано только на половину: "Рассол ведь получает тепло, т.е энергию из погреба торговца, следовательно, у Вас энергию не украли, а, наоборот, Вы получили энергию в подарок". Тогда владелец обратился в суд третьей инстанции. Что ответил этот судья?
Необратимые процессы: разрядка аккумулятора через металлическую спираль, передача тепла от горячего тела к холодному, смешение в прозрачной коробке белых и черных шаров, превращение работы в тепло, испарение воды из сосуда, заполнение газом всего предоставленного объема (можно в форме игры с учениками: называю прямой процесс, а ученики – обратный). Почему только одно название обратного процесса вызывает смех?
Date: 2015-05-09; view: 2147; Нарушение авторских прав