
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Доказательство закона Гесса
|
|
Если в системе протекает химический процесс и отсутствуют другие виды работ кроме работы расширения, можно, исходя из (3), записать:
- для изохорного процесса (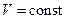 )
) 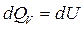 ,
,
где dQV - тепловой эффект реакции при изохорном процессе;
- для изобарного процесса (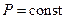 )
) 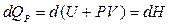 ,
,
где dQР - тепловой эффект реакции при изобарном процессе.
Таким образом, если из данных исходных веществ можно различными путями получить заданные конечные продукты, то независимо от вида промежуточных стадий суммарный тепловой эффект реакции будет одинаковым.
Например, оксид азота (II) можно получить двумя путями (рис. 1):
1) сжигая азот в кислороде непосредственно до N2O4 г,
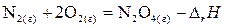 ;
;
2) провести этот процесс в 2 стадии - получить вначале оксид азота (I), а затем окислить его до оксида азота (II)
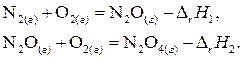
Оба эти пути имеют одинаковые начальные (N2 (г) и O2 (г)) и конечные состояния (N2O4 (г)). Если описанные процессы протекают в одинаковых условиях (температура, давление), одинаковых агрегатных состояниях, то согласно закону Гесса можно записать 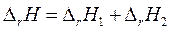 .
.
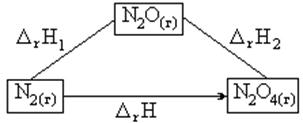
Рис. 1.Схематическое пояснение
закона Гесса на примере
получения оксида азота (IV)
различными путями
Под тепловым эффектом химической реакции понимают количество теплоты, которое выделяется или поглощается при условиях:
· процесс протекает необратимо при постоянном объеме или давлении,
· в системе не совершается никаких работ кроме работы расширения (PdV),
· продукты реакции имеют ту же температуру, что и исходные вещества.
Тепловой эффект реакции при изобарном процессе отличается от теплового эффекта при изохорном процессе на работу, совершаемую системой (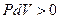 ) или над системой (
) или над системой (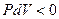 ), что видно из уравнений (4) и (5)
), что видно из уравнений (4) и (5)
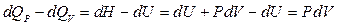 . ( 9)
. ( 9)
Если система подчиняется законам идеального газа, то согласно уравнению Менделеева - Клапейрона
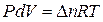 ,
,
где Dn - изменение количества газообразных веществ в молях,
R - универсальная молярная газовая постоянная, равная 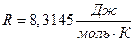 .
.
Тогда 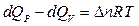 . (10)
. (10)
Если в реакции наряду с газами участвуют твёрдые или жидкие вещества, то при вычислении Dn необходимоучитывать изменение числа молей только для газообразных веществ.
Для реакций в конденсированной фазе 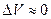 и
и 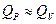 .
.
Химические реакции чаще проводят при постоянном давлении, чем при постоянном объёме.
Тепловой эффект считают положительным для эндотермических реакций и отрицательным для экзотермических процессов. Условимся записывать тепловой эффект реакции при постоянном давлении DrН.
Тепловой эффект реакции определяется не только природой реагирующих веществ, но и их агрегатным состоянием, поэтому в термодинамическом уравнении через символы (г), (ж), (т), (к) обозначают соответственно газообразное, жидкое, твердое (кристаллическое) агрегатные состояния веществ. Кроме того, в таких уравнениях указывается тепловой эффект реакции. Например,
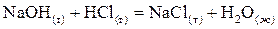 ;
; 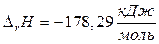 .
.
Тепловой эффект реакции - функция, обладающая экстенсивными свойствами (т.е. зависит от количества вещества), поэтому его можно отнести к 1 молю любого исходного вещества или конечного продукта реакции.
Тепловой эффект реакции зависит от температуры. Закон Гесса позволяет рассчитать тепловой эффект реакции в стандартных условиях - стандартный тепловой эффект реакции.
Под стандартным тепловым эффектом DrН0 (298 ) понимают его величину при стандартном давлении 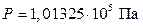 (760 мм рт. ст. = 1 атм) и температуре
(760 мм рт. ст. = 1 атм) и температуре 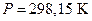 .
.
За стандартное состояние жидкого или твёрдого (кристаллического) вещества принимается его наиболее устойчивое физическое состояние при данной температуре и нормальном атмосферном давлении.
В качестве стандартного состояния для газа принято гипотетическое состояние, при котором газ, находясь под давлением 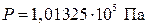 , подчиняется законам идеального газа, а его энтальпия равна энтальпии идеального газа.
, подчиняется законам идеального газа, а его энтальпия равна энтальпии идеального газа.
Date: 2015-05-09; view: 3280; Нарушение авторских прав