
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Химическая термодинамика
|
|
ТЕРМОДИНАМИКА
Учебно-методическое пособие к практическим занятиям
по физической химии
для студентов специальности МАХП
Березники 2009
УДК 541.11
ББК 24.5
К 60
Составитель В.Д. Колбасина
Рецензент: канд. техн. наук Б.С. Дыблин
Термодинамика. Часть I: Учебно-метод. пособие/ Сост.: В.Д. Колбасина; Перм. гос. техн. ун-т. Пермь, 2009. 77 с.
Пособие полностью соответствует программам по физической химии для студентов инженерного факультета и предназначено для приобретения навыков самостоятельной работы при решении задач, а также для подготовки к лабораторному практикуму.
Состоит из двух разделов. В первом рассмотрены основные понятия и законы термодинамики, примеры решения задач. Кроме того, представлены варианты типовых заданий для расчетных работ. Второй раздел представляет собой лабораторный практикум по калориметрии, включающий три лабораторные работы.
© Государственное образовательное учреждение высшего профессионального образования
Пермский государственный технический университет, 2009
ОГЛАВЛЕНИЕ
1. ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА.. 4
1.1. Основные понятия термодинамики. 4
1.2. Первый закон термодинамики. 11
1.2.1. Формулировки первого закона термодинамики. 11
1.2.2. Математическое выражение первого закона термодинамики для различных процессов 11
1.3. Закон Гесса. 14
1.3.1. Формулировка закона Гесса. 14
1.3.2. Доказательство закона Гесса. 14
1.3.3. Следствия закона Гесса. 16
1.3.4. Способы расчета теплот образования соединений. 21
1.4. Зависимость теплового эффекта реакции от температуры (уравнение Кирхгофа) 25
1.4.1. Теплоемкость. 25
1.4.2. Примеры расчета теплового эффекта реакций. 28
1.5. Второй закон термодинамики. 32
1.5.1. Формулировки второго закона термодинамики. 32
1.5.2. Физический смысл энтропии. 33
1.5.3. Вычисление энтропии. 34
1.5.4. Изохорно-изотермический потенциал (свободная энергия Гельмгольца) 41
1.5.5. Изобарно-изотермический потенциал (энергия Гиббса) 43
1.5.6. Уравнения Гиббса-Гельмгольца. 44
1.5.7. Взаимосвязь между D S, D F, D G, D H и направлением процессов в закрытых системах 45
1.5.8. Расчетные формулы энергии Гиббса и энергии Гельмгольца. 46
1.6. Третий закон термодинамики. 56
1.7. Варианты заданий для расчетных работ. 58
2. ЛАБОРАТОРНЫЙ ПРАКТИКУМ... 60
2.1. Правила техники безопасности при работе в лаборатории физической химии. 60
2.1.1. Основные правила поведения в лаборатории. 60
2.1.2. Работа с химической посудой. 60
2.1.3. Работа с кислотами и щелочами. 61
2.1.4. Работа с легковоспламеняющимися и горючими жидкостями. 62
2.1.5. Работа с электрическими приборами. 63
2.2. Лабораторная Работа № 1. 65
Определение интегральной теплоты растворения соли. 65
2.2.1. Теоретическая часть. 65
2.2.2. Порядок проведения работы.. 67
2.3. Лабораторная Работа № 2. 69
Определение теплоты реакции нейтрализации. 69
2.3.1. Теоретическая часть. 69
2.3.2. Порядок проведения работы.. 69
2.4. Лабораторная Работа № 3. 70
Определение теплоты реакции окисления. 70
2.4.1. Теоретическая часть. 70
2.4.2. Порядок проведения работы.. 71
2.5. Правила работы с термометром Бекмана. 73
2.6. Вычисление Dt 74
2.7. Порядок оформления лабораторных работ. 74
БИБЛИОГРАФИЧЕСКИЙ СПИСОК.. 76
ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА
Термодинамика - наука, изучающая превращения различных видов энергии при тех взаимодействиях между телами, которые ограничиваются только тепловым обменом или работой.
Основные понятия термодинамики
Термодинамическая система - это тело или группа тел, находящихся во взаимодействии и отделенных от окружающей среды границей раздела.
Классификация систем.
1. По составу система может быть:
· гомогенная - это однородная система, между отдельными частями которой нет поверхностей раздела. Каждый параметр такой системы имеет во всех ее точках одно и то же значение или может плавно изменяться при переходе от одной точки к другой;
· гетерогенная - состоит из различных по свойствам частей, между которыми существует граница раздела, где некоторые параметры могут меняться скачкообразно. Например, система, состоящая из жидкой воды и кусочков льда, имеет две фазы – воду и лед.
Фаза – это совокупность всех гомогенных частей системы, одинаковых по составу и по всем химическим и физическим свойствам (параметрам) и ограниченных от других частей системы поверхностями раздела.
Фаза может быть:
· простой, если она состоит из молекул одного вида;
· смешанной, если она состоит из молекул разного вида.
Пример: Дистиллированная вода - это простая фаза, а водопроводная вода, в состав которой входят растворенные соли и кислород, - смешанная фаза.
Любая гомогенная система состоит из одной фазы. Гетерогенная система содержит не менее двух фаз.
Понятие “фаза” не тождественно понятию “агрегатное состояние”. Например, система, состоящая из воды и бензина, имеет одно агрегатное состояние - жидкое, но две фазы - воду и бензин, которые отличаются по своим свойствам и составу.
2. По отношению к окружающей среде системы могут быть:
· изолированные -не обмениваются с окружающей средой ни массой, ни энергией (в форме теплоты или работы) и имеют постоянный объем;
· закрытые - обмениваются с окружающей средой энергией, но не обмениваются массой;
· открытые - обмениваются с окружающей средой и массой, и энергией.
Параметры системы – этовеличины, характеризующие состояние системы.
Реальная система обладает большим числом параметров. Поэтому в термодинамике обычно принимают условие, согласно которому описание системы считается полным, если заданы значения вполне определенных параметров. Например, для разряженных газов такими параметрами будут P, V, T, C. В более сложных системах приходится учитывать поверхностное натяжение, намагниченность, электропроводность и другие параметры.
Параметры делятся на:
· экстенсивные (емкостные), которые количественно пропорциональны массе. Их иногда называют факторами емкости. К таким параметрам относятся объем (V), масса (m), внутренняя энергия (U), энтальпия (H) и др.;
· интенсивные, которые не зависят от массы, а определяются лишь специфической природой системы. Это давление (Р), температура (Т), химический потенциал (m) и др.
Параметры, которые измеряются непосредственно и выражают интенсивные свойства системы, называются термодинамическими параметрами. Экстенсивный параметр станет интенсивным, если он будет отнесен к единице количества вещества. Например, масса и объем - экстенсивные параметры, а плотность и удельный объем - интенсивные свойства вещества или системы.
Функции процесса - это функции, связанные с процессом. Такие функции не являются свойствами системы. Величина их будет зависеть от вида процесса. К ним относятся теплота и работа.
· Теплота -это способ передачи энергии от одной части системы к другой через хаотическое движение молекул.
Теплота связана с процессом, она зависит от пути процесса. Теплоту, полученную системой от окружающей среды, считают положительной, а теплоту, отданную системой, - отрицательной.
Конечное количество теплоты обозначают Q, а бесконечно малое количество теплоты - через d Q. Единицы измерения теплоты Дж или кДж.
· Работа - это способ передачи энергии путем упорядоченного движения большого числа частиц под действием каких-либо сил.
Работа, как и теплота, зависит от пути процесса. Работу обозначают через W, бесконечно малую величину работы - через d W. Единицы измерения работы Дж или кДж.
Функции состояния системы -это такие функции, значения которых зависят от состояния системы, но не зависят от пути, по которому система пришла в данное состояние. Примерами таких функций являются внутренняя энергия, энтальпия и т. д.
· Внутренняя энергия (U) - совокупность всех видов энергий частиц в системе.
Абсолютное значение внутренней энергии не может быть определено, поэтому при расчетах всегда оперируют ее изменением: 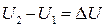 , где U1 и U2 - значения внутренней энергии системы в начальном и конечном ее состоянии, а D U - изменение внутренней энергии. Бесконечно малое изменение внутренней энергии обозначают dU.
, где U1 и U2 - значения внутренней энергии системы в начальном и конечном ее состоянии, а D U - изменение внутренней энергии. Бесконечно малое изменение внутренней энергии обозначают dU.
Внутренняя энергия - функция состояния, и поэтому при круговых процессах изменение внутренней энергии системы равно нулю, т.е. интеграл по замкнутому контуру от функции состояния равен нулю.
Величина dU - положительная, если внутренняя энергия при протекании процесса возрастает в системе (т.е. над системой совершается работа), и отрицательная, если внутренняя энергия убывает (т.е. система сама совершает работу или теплоотдачу).
Внутренняя энергия зависит:
- от природы вещества,
- его массы,
- параметров состояния системы.
Внутренняя энергия является экстенсивным свойством системы, поэтому ее относят обычно к 1 молю вещества и выражают в Дж или кДж.
В общем случае для системы, содержащей 1 моль вещества, внутренняя энергия зависит от давления (P), объема (V) и температуры (Т), т.е.
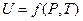 или
или 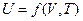 .
.
Если же рассматривать идеальный газ, где отсутствуют силы межмолекулярного взаимодействия, то энергия такого газа не зависит от Р и V, т.е.
 и
и 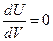 .
.
Внутренняя энергия идеального газа является только функцией температуры U = f(T). Этот вывод в некотором приближении можно распространить и на реальные газы при невысоких давлениях, когда силами взаимодействия между молекулами можно пренебречь.
Энтальпия. Если в системе протекают процессы при постоянном давлении, то удобнее пользоваться величиной энтальпии Н, которая определяется соотношением 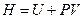 .
.
Энтальпия, как и внутренняя энергия, характеризует энергетическое состояние системы, но она включает еще и энергию, затрачиваемую на преодоление внешнего давления, т.е. на работу расширения (PV).
Подобно внутренней энергии энтальпия определяется состоянием системы, и не зависит от того, каким путем это состояние достигнуто.
Абсолютное значение энтальпии, как и внутренней энергии, не может быть определено, поэтому при расчетах всегда оперируют ее изменением, 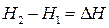 , где Н 1 и Н2 - значения энтальпии системы в начальном и конечном ее состоянии, а DН - изменение энтальпии энергии. Бесконечно малое изменение энтальпии обозначают dН.
, где Н 1 и Н2 - значения энтальпии системы в начальном и конечном ее состоянии, а DН - изменение энтальпии энергии. Бесконечно малое изменение энтальпии обозначают dН.
Как и внутренняя энергия, энтальпия является экстенсивным свойством системы, поэтому ее относят обычно к 1 молю вещества и выражают в Дж или кДж.
Если системы не содержат газов, изменения внутренней энергии и энтальпии близки друг к другу. Это объясняется тем, что изменения объема (DV) в процессах, протекающих в системах с твердыми и жидкими веществами, обычно очень невелики и величина РDV мала по сравнению с DН.
В случае газов различие между DU и DН в ходе того или иного процесса может быть значительным.
На практике технологические процессы протекают преимущественно при P = const, поэтому во всех справочниках приводится значение энтальпии, а не внутренней энергии.
Однако, зная DН можно рассчитать и изменение внутренней энергии (DU) в термодинамических процессах.
Рассмотрим несколько случаев расчета DU:
а) конденсированные системы (твердые и жидкие), не содержащие газообразных веществ. В них изменение объема (DV) в термодинамических процессах незначительно и поэтому принимают 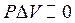 . Тогда
. Тогда 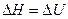 ;
;
б) системы, содержащие газообразные вещества. Предположим, что газы близки по свойствам к идеальным газам и подчиняются уравнению Клапейрона – Менделеева:
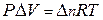 .
.
Отсюда 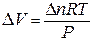 .
.
Заменив DV в уравнении энтальпии, получим:
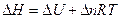 ,
,
где 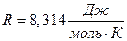 – универсальная газовая постоянная;
– универсальная газовая постоянная;
Т – температура, при которой протекает процесс (в К);
Dn – разность молей конечных и исходных газообразных веществ, т.е.
Dn = nкон – nисх, где
nкон, nисх – количество молей газообразных конечных и исходных веществ.
Рассмотрим несколько конкретных примеров.
Пример 1. Пусть протекает реакция
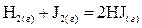 .
.
Энтальпия реакции рассчитывается из справочных данных, а DU из формулы 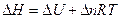 .
.
В этом случае 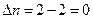 , тогда
, тогда 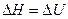 .
.
Пример 2. Если взять тоже уравнение реакции, но J 2 использовать твердый.
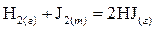 ,
,
то в этом случае 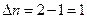 и тогда
и тогда 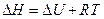 ,
,
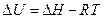 .
.
Пример 3. Рассмотрим уравнение
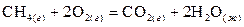 .
.
В этом случае 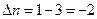 , тогда
, тогда
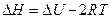 ,
,
откуда 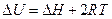 .
.
При изменениях агрегатного состояния вещества, при аллотропных переходах изменение энтальпии равно по величине, но обратно по знаку теплоте соответствующего превращения. При химической реакции изменение энтальпии равно взятому с обратным знаком тепловому эффекту реакции, проведенной при постоянном давлении и постоянной температуре.
Термодинамические процессы. Любое изменение в системе, связанное с изменением хотя бы одного термодинамического параметра, называется термодинамическим процессом.
Классификация термодинамических процессов.
· Круговой (циклический) - процесс, при котором система, выйдя из некоторого начального состояния и претерпев ряд изменений, возвращается в то же самое состояние. В этом процессе изменение любого параметра состояния равно нулю.
· Обратимый - процесс, после которого можно вернуть систему и окружающую её среду в прежнее состояние. При этом в обратном процессе система проходит через те же промежуточные состояния, что и в прямом процессе, но только в обратном порядке. Обратимые процессы являются идеальными. Реально к ним можно приблизиться, но нельзя достигнуть. Однако этим понятием пользуются часто, т.к. работа в таком процессе максимальна и, сравнивая ее с работой необратимого процесса, можно судить об эффективности прямого и обратного процессов. И другое: выбирая границы системы так, чтобы не было больших перепадов температур (Т), давления (Р) и концентрации вещества (С), реальный процесс (например, химическую реакцию) можно представить протекающим бесконечно медленно и обратимо. Это позволяет наиболее просто рассчитать изменения термодинамических свойств системы.
· Необратимый - процесс, после которого систему и окружающую среду нельзя одновременно вернуть в прежнее состояние.
При необратимых процессах систему можно вернуть в прежнее состояние, но при этом в окружающей среде произойдут изменения.
· Самопроизвольный - процесс, который совершается в системе без вмешательства со стороны окружающей среды. Его относят к положительному или естественному процессу. Например, переход вещества из области большей концентрации в область меньшей (диффузия), переход тепла от более горячего тела к холодному и т.д.
· Несамопроизвольный - процесс, который не может совершаться сам по себе без вмешательства извне. Его называют отрицательным, или неестественным. Например, переход вещества из области меньшей в область большей концентрации, переход тепла от холодного тела к горячему и т.д.
· Равновесным, или квазистатическим, называется процесс, в котором параметры изменяются бесконечно медленно, и система последовательно проходит через ряд состояний, бесконечно мало отличающихся от равновесного. Силы, действующие на систему, почти точно уравновешиваются силами со стороны системы.
Равновесному процессу свойственна двусторонность. Другая особенность равновесного процесса - отсутствие потерь энергии на преодоление трения, завихрений потоков в газах и жидкостях. Работа, совершаемая системой против внешней среды в равновесном процессе, максимально возможна. Энергия же, рассеянная в виде теплоты, минимальна.
Равновесие - это такое состояние изолированной системы, в которое она приходит самопроизвольно и из которого не может выйти без внешнего воздействия.
Изолированные системы, предоставленные сами себе, в результате выравнивания Т, Р и завершения химических реакций в конце концов перестают изменяться.
Если равновесная система, выведенная из состояния равновесия, вновь возвращается в него, то время, необходимое для этого, называется временем релаксации.
· Неравновесный процесс отличается от равновесного конечной скоростью, которая обусловлена:
- конечной разностью температур, давления и других параметров между системой и внешней средой,
- большой неравномерностью температурных, концентрационных и других полей внутри системы. В этом случае, даже если снять внешнее воздействие на систему, процесс не прекратится.
Например, если убрать нагрев, то первоначальное тепло, уже сообщенное системе, будет распространяться до тех пор, пока не выровняется температура.
Неравновесный процесс - односторонний процесс. Работа в этом процессе, совершаемая системой, меньше, чем в равновесном процессе. Часть энергии тратится на преодоление некоторых сопротивлений (например, завихрения потоков в газах и жидкостях) и превращается в бесполезную работу, количество которой равно разности между максимальной работой в равновесном процессе и соответствующей работой в неравновесном процессе. Протекание неравновесного процесса сопровождается потерей работоспособности системы.
По отношению к постоянным параметрам процессы делятся на:
1) изотермический 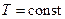 ;
;
2) изобарный 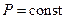 ;
;
3) изохорный 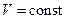 ;
;
4) адиабатный 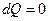 (в системе отсутствует теплообмен).
(в системе отсутствует теплообмен).
Date: 2015-05-09; view: 1519; Нарушение авторских прав