
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Первый закон термодинамики
|
|
Первый закон термодинамики является частным случаем общего закона сохранения и превращения энергии применительно к тепловым процессам, протекающим в термодинамических системах, как изолированных, так и неизолированных от окружающей среды.
Если к рабочему телу подводится некоторое количество тепла, то оно расходуется на увеличение внутренней энергии самого рабочего тела и на совершение работы. Первый закон термодинамики устанавливает связь между изменением внутренней энергии тела в каком-либо термодинамическом процессе и энергией, переданной в форме работы и теплоты.
Таким образом, уравнение первого закона термодинамики для 1 кг однородного вещества можно записать следующим образом:
а) для элементарного процесса
dq = du + dl; (6.1)
б) для конечного процесса
q = 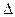 u + l, (6.2)
u + l, (6.2)
где q – количество тепла (оно считается положительным при подводе и
отрицательным при отводе его от системы), кДж / кг;
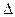 u – изменение внутренней энергии в процессе, кДж / кг;
u – изменение внутренней энергии в процессе, кДж / кг;
l – работа в процессе (она считается положительной, когда само тело
совершает работу, т.е. при расширении газа, и отрицательной
при подводе работы к газу, т.е. при его сжатии), кДж / кг.
Внутренняя энергия идеального газа зависит только от его температуры и является экстенсивным параметром. Поэтому изменение внутренней энергии зависит от начального и конечного состояния системы, не зависит от характера процесса и определяется по формулам:
du = c 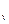 dT; (6.3)
dT; (6.3)
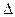 u =
u = 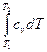 =
= 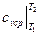
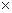 (T
(T  - T
- T  ), кДж / кг, (6.4)
), кДж / кг, (6.4)
где 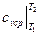 – средняя изохорная теплоёмкость в интервале температур
– средняя изохорная теплоёмкость в интервале температур
от T  до T
до T  , кДж / (кг град).
, кДж / (кг град).
Работа процесса может быть вычислена, если известна зависимость давления от объёма в ходе процесса или уравнение процесса:
l = 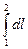 = 10
= 10 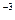
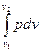 , кДж / кг, (6.5)
, кДж / кг, (6.5)
где p – давление в Н / м 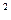 .
.
Количество тепла вычисляется по формуле:
q 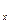 = c
= c 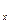 (T
(T  - T
- T  ), кДж / кг, (6.6)
), кДж / кг, (6.6)
где c 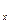 – теплоёмкость газа в рассматриваемом процессе, кДж / (кг град).
– теплоёмкость газа в рассматриваемом процессе, кДж / (кг град).
Используя выражение для энтальпии:
i = u + pv, (6.7)
получаем иную зависимость для первого закона термодинамики:
dq = di – vdp, (6.8)
где vdp = dl 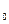 – располагаемая работа, кДж / кг.
– располагаемая работа, кДж / кг.
Энтальпия идеального газа зависит только от его температуры, не зависит от характера процесса и является экстенсивным параметром.
Изменение энтальпии в процессе определяется только начальным и конечным состоянием газа:
di = c 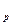 dT; (6.9)
dT; (6.9)
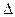 i =
i = 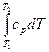 =
=  (T
(T  - T
- T  ), кДж / кг, (6.10)
), кДж / кг, (6.10)
где 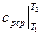 – средняя изобарная теплоёмкость газа в интервале температур
– средняя изобарная теплоёмкость газа в интервале температур
от T  до T
до T  , кДж / (кг град).
, кДж / (кг град).
Для рабочего тела массой G:
первый закон термодинамики –
Q = 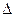 U + L, кДж; (6.11)
U + L, кДж; (6.11)
изменение внутренней энергии –
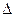 U = G
U = G 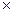 c
c 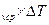 , кДж; (6.12)
, кДж; (6.12)
изменение энтальпии –
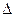 I = G
I = G 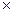 c
c 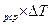 , кДж. (6.13)
, кДж. (6.13)
Вопросы для самоконтроля
1. Что понимается под внутренней энергией идеального и реального газов?
2. От каких параметров состояния зависит внутренняя энергия реального и идеального газов?
3. Является ли внутренняя энергия функцией состояния или процесса?
4. Чему равно изменение внутренней энергии в круговом процессе?
5. Что изображает площадь под кривой процесса в 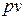 -диаграмме?
-диаграмме?
6. Показать, что работа является функцией процесса.
7. Какая работа газа больше: в обратимом или необратимом процессе и почему?
8. Формулировка первого закона термодинамики.
9. Аналитическое выражение первого закона термодинамики.
Date: 2015-05-09; view: 756; Нарушение авторских прав