
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Уравнение состояния идеального газа. Газовые законы
|
|
4.1. Основные понятия и закономерности.
Еще философы древности догадывались о том, что теплота - это вид внутреннего движения. Но только в 18 веке начала развиваться молекулярно-кинетическая теория (МКТ). Цель МКТ - объяснение свойств макроскопических тел и тепловых процессов, протекающих в них, на основе представлений о том, что все тела состоят из отдельных, беспорядочно движущихся частиц. В основе МКТ строения вещества лежат три утверждения:
- вещество состоит из частиц;
- эти частицы беспорядочно движутся;
- частицы взаимодействуют друг с другом.
Качественное объяснение основных свойств газов на основе МКТ не является особенно сложным. Однако теория, устанавливающая количественные связи между измеряемыми на опыте величинами и свойствами самих молекул, их числом и скоростью, весьма сложна. Вместо реального газа, между молекулами которого действуют сложные силы взаимодействия, мы будем рассматривать его физическую модель. Эта модель называется идеальным газом.
Идеальный газ - это газ, взаимодействие, между молекулами которого пренебрежимо мало и молекулы не занимают объема.
Для описания процессов в газах и других макроскопических телах нет необходимости всё время обращаться к МКТ. Величины, характеризующие состояние макроскопических тел без учета молекулярного строения тел называют макроскопическими параметрами. Это объем, давление и температура. Уравнение, связывающее все три макроскопических параметра вместе, называют уравнением состояния идеального газа. Оно имеет еще одно название - уравнение Менделеева - Клапейрона. Получим его:
 |

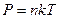 ,
, 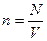 ,
, 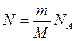 ,
, 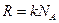
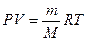
Можно заметить, что это уравнение получено для газа любой массы. Для газа неизменной массы эту зависимость можно представить в следующем виде:
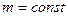 ,
, 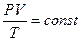 ,
, 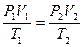
Это уравнение получило название - уравнение Клапейрона. Как можно заметить уравнение Клапейрона является частным случаем уравнения состояния идеального газа.
C помощью уравнения состояния идеального газа можно исследовать процессы, в которых масса газа и один из трех макроскопических параметров остаются неизменными. Количественные зависимости между двумя параметрами при фиксированном значении третьего параметра называют газовыми законами. Процессы, протекающие при неизменном значении одного из параметров, называют изопроцессами.
ИЗОТЕРМИЧЕСКИЙ ПРОЦЕСС - процесс изменения состояния термодинамической системы (газ) макроскопических тел при постоянной температуре называют изотермическим.
В частом случае этого явления, когда масса газа не изменяется, получается газовый закон, носящий имя закона Бойля-Мариотта. Для газа данной массы произведение давления газа на его объём постоянно, если температура газа не меняется. Математическая запись закона выглядит так:
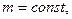
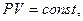
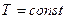
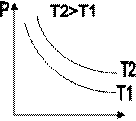
Зависимость макроскопических параметров в различных осях выглядит следующим образом:
 |  | ||||||||||||||
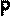 | |||||||||||||||
 | |||||||||||||||
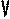 | |||||||||||||||
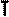 | |||||||||||||||
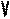 | 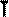 | ||||||||||||||
Легко заметить, что изотерме располагающейся выше в осях P,V соответствует большая абсолютная температура.
ИЗОБАРНЫЙ ПРОЦЕСС - процесс изменения состояния термодинамической системы (газ) при постоянном давлении называют изобарным.
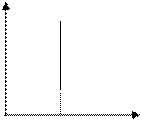
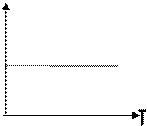
В частом случае этого явления, когда масса газа не изменяется, получается газовый закон, носящий имя закона Гей-Люссака. Для газа данной массы отношение объёма к температуре постоянно, если давление газа не меняется. Математическая запись закона выглядит так:
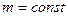 ,
, 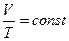 ,
, 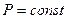
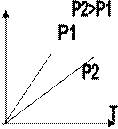
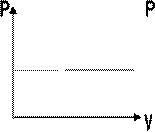
Зависимость макроскопических параметров в различных осях выглядит следующим образом:
 | |||||||
 | |||||||
 | |||||||
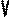 | |||||||
 Нетрудно определить, что изобаре в осях V,T имеющей меньший угол наклона к оси температур соответствует большее давление.
Нетрудно определить, что изобаре в осях V,T имеющей меньший угол наклона к оси температур соответствует большее давление.
ИЗОХОРНЫЙ ПРОЦЕСС - процесс изменения состояния термодинамической системы (газ) при постоянном объёме называют изохорным.
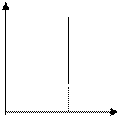
В частом случае этого явления, когда масса газа не изменяется, получается газовый закон, носящий имя закона Шарля. Для газа данной массы отношение давления к температуре постоянно, если объём газа не меняется. Математическая запись закона выглядит так:
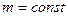 ,
, 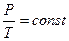 ,
, 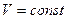
Зависимость макроскопических параметров в различных осях выглядит следующим образом:
 | |||||||||||||
 | |||||||||||||
 | |||||||||||||
 | |||||||||||||
 |  | ||||||||||||
 | |||||||||||||
Нетрудно определить, что изохоре в осях P,T имеющей меньший угол наклона к оси температур соответствует больший объём.
Date: 2015-05-09; view: 1502; Нарушение авторских прав