
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Наиболее вероятная скорость. Метод анализа размерностей
|
|
Перейдем к исследованию и анализу полученной функции распределение Максвелла (3.30). Найдем положение максимума, т. е. такую скорость, которую имеет наибольшая доля (или число) молекул при равных интервалах разделения молекул по скоростям (один и тот же интервал dV).
Вычисляем производную и приравниваем ее к нулю: dF (V)/ dV = 0, или
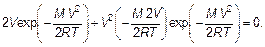 (3.33)
(3.33)
Производная берется по формуле производной от произведения. Производная от экспоненты берется как производная «сложной» функции.
Постоянная величина, не зависящая от скорости, сокращена. Сокращая последнюю формулу на V и на экспоненту, получим, что скорость, которой соответствует наибольшая доля молекул, т. е. наиболее вероятная(наивероятнейшая)скорость V нв(такая, что двигаться с этой скоростью молекула имеет наибольшую вероятность) будет
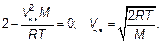 (3.34)
(3.34)
Видим, что эта скорость отличается от среднеквадратичной
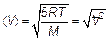 (3.35)
(3.35)
Среднеквадратичная скорость несколько больше.
Для анализа распределения Максвелла удобно использовать метод анализа размерностей.
В распределении молекул по величине скорости V (распределение Максвелла) есть экспонента
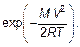 (3.36)
(3.36)
Величина МV 2/(2 RT), очевидно, безразмерна. Независимой переменной является V — величина (модуль) скорости молекулы. Но вспомним, ведь
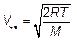 (3.37)
(3.37)
Это наиболее вероятная скорость (3.35), скорость, на которой приходится максимум функции распределения, та скорость, с которой движется наибольшая доля молекул. Оценим ее в воздухе вокруг нас:
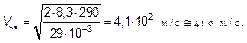 (3.38)
(3.38)
Эта огромная с нашей человеческой точки зрения скорость (для человека характерна скорость 1 м/с) является естественной единицей скоростей молекул воздуха вокруг нас.
Таким образом, в действительности распределение молекул по скорости зависит от безразмерной величины V / V нв, которая представляет собой скорость молекулы, измененную в естественных для данного явления (молекулярного движения) единицах.
Для записи, как вероятностей, так и количества молекул, удобно ввести безразмерную (относительную) скорость и как отношение скорости V и наиболее вероятной:
 (3.39)
(3.39)
Полностью доля молекул, имеющих скорости, лежащие в интервале от V до V + dV (вероятность, что молекула имеет такую скорость), записывается в виде (3.30) или
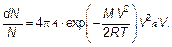 (3.40)
(3.40)
Ее нужно переписать, введя везде наиболее вероятную скорость. Затем вычисляется постоянная А. Это можно сделать, используя условие нормировки, а именно первую из формул (3.11). Имеем
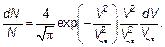 (3.41)
(3.41)
Наконец, распределение Максвелла(рис. 3.15) в наиболее естественном безразмерном виде (ведь «доля» — вероятность также безразмерна) запишется как:
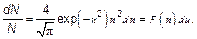 (3.42)
(3.42)
Эта формула наиболее компактная и самая универсальная, т. е. в ней не проявляются несущественные для данного явления величины вроде молярной массы или температуры (хотя эти величины могут быть очень существенны для нас — пользователей этой формулы).
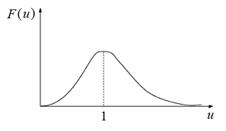
Рис. 3.15. Распределение Максвелла в безразмерной форме (в естественных единицах)
Распределение Максвелла имеет множество применений. Например, для определения возможности и скорости химической реакции важно знать тепловой эффект реакции. Распределение Максвелла позволяет понять роль теплового эффекта. Действительно, в реакцию вступают лишь те молекулы, которые преодолели энергетический барьер (примерно равный глубине энергетической ямы ε в эмпирическом потенциале Леннард–Джонса (см. гл. 3)). Число молекул с такой, достаточной для вступления в реакцию энергией определяется распределением Максвелла.
Молекулы с достаточной энергией составляют так называемый хвост распределения. На рис. 3.16 хвост распределения заштрихован. Заштрихованная площадь составляет долю молекул, которые могут вступить в реакцию с барьером не более чем ε ≤ M (rV нв)2/2 Дж/моль.
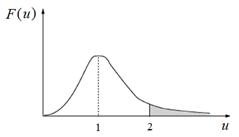
Рис. 3.16. Распределение молекул по относительным скоростям. Заштрихована доля молекул, скорости которых вдвое превышают наивероятнейшую скорость
Date: 2015-05-08; view: 986; Нарушение авторских прав