
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Лабораторная работа №6
|
|
Определение измерения энтропии
Цель работы
Опытным путем установить зависимость изменения энтропии от теплоемкости тел при выравнивании температур тел в изолированной адиабатической термодинамической системе.
Общие положения
Так же как и внутренняя энергия, энтропия является функцией состояния термодинамической системы. Если термодинамическая система получает в обратимом процессе количество теплоты δQ при температуре Т, то отношение δQ /T определяет изменение энтропии dS системы, т.е. 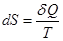 и для обратимого процесса является полным дифференциалом. На практике обычно интересуются только изменением энтропии, а не ее абсолютным значением.
и для обратимого процесса является полным дифференциалом. На практике обычно интересуются только изменением энтропии, а не ее абсолютным значением.
Изменение энтропии системы можно найти, используя второе начало термодинамики 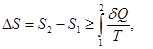
где интеграл берется по пути термодинамического процесса между состояниями 1 и 2, где S1 и S2 - значения энтропии в этих состояниях. Знак равенства соответствует обратимому процессу, а знак неравенства - необратимому.
Второе начало термодинамики утверждает, что при обратимом процессе изменение энтропии системы равно интегралу от 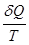 между состояниями 1 и 2 по обратимому пути и больше этого интеграла по пути необратимому, т.е. в этом случае интеграл от
между состояниями 1 и 2 по обратимому пути и больше этого интеграла по пути необратимому, т.е. в этом случае интеграл от 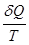 не выражает изменение энтропии, а меньше его.
не выражает изменение энтропии, а меньше его.
Представляет интерес изучение изменения энтропии в изолированной адиабатической системе.
Изменение энтропии в изолированной адиабатической системе при квазистатическом (обратимом) процессе равно нулю, так как 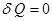 , т.е.
, т.е. 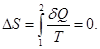
В случае необратимых процессов в изолированной адиабатической системе 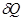 также равно нулю, но изменение энтропии в такой системе уже нулю не равно и по формуле для обратимых процессов не может быть вычислено. Это вычисление можно сделать, если учесть, что энтропия есть функция состояния системы и ее применение не зависит от характера пути процесса в системе, т.е. обратимого или необратимого. В этом случае для вычисления изменения энтропии можно воспользоваться любым квазистатическим (обратимым) процессом, переводящим систему из состояния 1 в 2, т.е.
также равно нулю, но изменение энтропии в такой системе уже нулю не равно и по формуле для обратимых процессов не может быть вычислено. Это вычисление можно сделать, если учесть, что энтропия есть функция состояния системы и ее применение не зависит от характера пути процесса в системе, т.е. обратимого или необратимого. В этом случае для вычисления изменения энтропии можно воспользоваться любым квазистатическим (обратимым) процессом, переводящим систему из состояния 1 в 2, т.е. 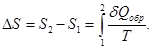
В случае выравнивания температуры от T1 до Т2 твердых и жидких тел в изолированной адиабатической системе этот реальный процесс можно заменить изобарическим квазистатическим (обратимым) переходом теплоты между телами. При изобарическом процессе 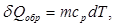
где m - масса тела, сР – удельная теплоемкости тела при постоянном давлении. Для характеристики теплоемкости тел используется также и удельная теплоемкость при постоянном объеме – cV. У жидких и твердых тел разница между cр и cV сравнительно мала, так что можно положить cp ≈ cV и говорить просто об удельной теплоемкости жидких и твердых тел c. Нужно помнить, что удельная теплоемкость вещества c зависит от температуры, т.е. c = c(Т). Тогда изменение энтропии в этом процессе можно определить
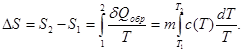
В нашем случае вместо c(Т) будем использовать среднее значение удельной теплоемкости c в интервале температур от T1 до Т2 и считать для этого температурного интервала среднее значение удельной теплоемкости c величиной постоянной, тогда изменение энтропии будем вычислять по формуле 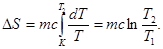
В силу того, что энтропия аддитивна, полное изменение энтропии термодинамической системы можно найти, если просуммировать изменения энтропии всех отдельных тел, входящих в состав этой системы, т.е. 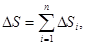
где ∆S - изменение энтропии всей системы; n - число тел системы; ∆Si - изменение энтропии одного из тел термодинамической системы.
Согласно первому началу термодинамики, 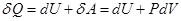 , сообщаемое термодинамической системе тепло
, сообщаемое термодинамической системе тепло 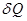 идет на изменение внутренней энергии системы dU и совершение системой работы
идет на изменение внутренней энергии системы dU и совершение системой работы 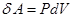 над внешними телами. В случае твердого и жидкого тел все сообщаемое тепло идет на изменение внутренней энергии, а так как объемы этих тел при нагревании почти не изменяются, то работой расширения
над внешними телами. В случае твердого и жидкого тел все сообщаемое тепло идет на изменение внутренней энергии, а так как объемы этих тел при нагревании почти не изменяются, то работой расширения 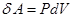 можно пренебречь, т.е., чем больше изменение энтропии в адиабатно-изолированной системе, тем большее количество тепла необратимо переходит во внутреннюю энергию системы. Поэтому необратимые потери тепла, связанные с реальными необратимыми термодинамическими процессами в адиабатно-изолированных системах, принято оценивать по изменению энтропии.
можно пренебречь, т.е., чем больше изменение энтропии в адиабатно-изолированной системе, тем большее количество тепла необратимо переходит во внутреннюю энергию системы. Поэтому необратимые потери тепла, связанные с реальными необратимыми термодинамическими процессами в адиабатно-изолированных системах, принято оценивать по изменению энтропии.
Если в калориметр, содержащий определенное количество воды при заданной температуре, опустить нагретое тело, то произойдет теплообмен и установится общая температура. Сам калориметр помещен во внешний стакан, в результате чего система становится почти адиабатно-изолированной.
Термодинамическому равновесию адиабатической системы соответствует состояние с максимумом энтропии, при этом температура вест частей системы в состоянии равновесия одинакова.
Изменение энтропии такой системы при выравнивании температуры погруженного тела и воды можно рассчитать по формулам 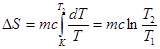 и
и 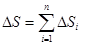 . В состав исследуемой системы входят: испытуемое тело массой mT с удельной теплоемкостью сT и начальной температурой Т0, вода калориметра массой mВ с удельной теплоемкостью сВ и начальной температурой Т0. После окончания процесса теплообмена установится температура Т.
. В состав исследуемой системы входят: испытуемое тело массой mT с удельной теплоемкостью сT и начальной температурой Т0, вода калориметра массой mВ с удельной теплоемкостью сВ и начальной температурой Т0. После окончания процесса теплообмена установится температура Т.
При выравнивании температуры энтропия каждого из тел изменяется:
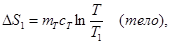
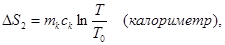
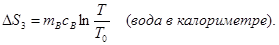
Учитывая аддитивность энтропии, можно записать ∆S = ∆S1 + ∆S2 + ∆S3.
Подставляя значения ∆S1, ∆S2, ∆S3, получим расчетную формулу изменения энтропии всей системы 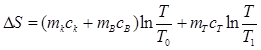
В данной работе
mB = 0,2 кг; СВ = 4,18·103 Дж/кг·К (при t=20ºC);
сT (железо)= 440,5 Дж/кг·К;
сT (латунь)= 384,7 Дж/кг·К;
сT (алюминий)= 896,1 Дж/кг·К.
В работе предлагается рассчитать изменение энтропии шести нагретых тел при опускании в калориметр с водой, температура и масса которой одинаковы в каждом эксперименте.
Date: 2015-05-08; view: 849; Нарушение авторских прав