
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Строение атома. Атом имеет сложное строение
|
|
Атом имеет сложное строение. В его центре расположено ядро, в котором сосредоточена почти вся его масса. Радиус ядра – около 10-14 м, что примерно в 10 000 раз меньше радиуса атома. Ядро состоит из протонов и нейтронов, связанных между собой ядерными силами. Протоны обладают элементарным положительным электрическим зарядом е = 1,6021892∙10-19 Кл [1]. Нейтроны не обладают электрическим зарядом, имея примерно такую же массу как протоны. Количество протонов в ядре Z определяет порядковый номер элемента в периодической системе элементов Д. И. Менделеева и его химические свойства. Вокруг ядра движется Z электронов, обладающих таким же по величине, но противоположным по знаку зарядом как протоны. Суммарный заряд электронов полностью нейтрализует заряд ядра, поэтому не ионизированные атомы электрически нейтральны. Электроны в атоме распределены по электронным оболочкам. Вращаясь вокруг ядра по замкнутым орбитам, они не излучают энергию, что и обеспечивает стабильность атомов. Электронные оболочки атомов расположены на различных расстояниях от ядра и характеризуются различными энергиями электронов. Электронные оболочки нумеруют, начиная от самой ближней к ядру. В каждой оболочке может находиться не более 2 n 2 электронов, где n – номер оболочки (следовательно, на первой оболочке может быть не более двух электронов, на второй – не более восьми, на третьей – не более 18-и и т.д.). Все электроны, находящиеся на одной оболочке, обладают одинаковой энергией Wn. С ростом n расстояние от ядра увеличивается, а энергия связи электронов этой оболочки с атомом уменьшается. Ближние к ядру оболочки принято обозначать латинскими буквами K, L, M, N и т.д. Чтобы удалить электрон, находящийся на n -ой оболочке, из атома, необходимо затратить энергию Wn, которая называется энергией связи электрона с атомом и равна энергии электрона, находящегося на данной оболочке. При переходе электрона с одной оболочки на другую электрон поглощает (при переходе на более удалённую оболочку) или испускает (при переходе на более близкую оболочку) энергию, равную разности энергий этих оболочек:
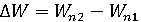 ,
,
где Wn1 и Wn2 – энергия электрона на соответствующих оболочках.
За единицу энергии в атомной и ядерной физике принят электрон-вольт (эВ), равный приращению энергии электрона при прохождении ускоряющего электрического поля в 1 В. 1 эВ = 1,6021892∙10-19 Дж [1].
Энергия частиц состоит из энергии покоя W 0 и кинетической энергии Е. Энергия покоя связана с массой частицы соотношением Эйнштейна:
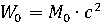 , (1.1)
, (1.1)
где М 0 – масса покоя частицы;
с = 2,99792458∙108 м/с – скорость света в вакууме [1].
Следовательно, масса движущейся частицы состоит из массы покоя М 0 и эквивалентной массы движения Е/с2.
Некоторые частицы (фотоны, нейтрино) не имеют массы покоя и обладают только массой движения М = Е/с2. Фотоны – частицы электромагнитного излучения движутся со скоростью света и не могут находиться в состоянии покоя. Заряд фотона равен нулю, а его энергия
Еф = hυ, (1.2)
где h = 6,626176∙10-34 Дж ∙с – постоянная Планка [1];
υ – частота излучения, Гц.
В невозбуждённом атоме электроны располагаются на самых близких к ядру оболочках. Это состояние атома называется основным. Под действием внешних сил (столкновений с заряженными частицами или фотонами) атомные электроны могут переходить на более удалённые оболочки, получая при этом от бомбардирующей частицы определённую порцию (квант) энергии. Такое состояние атома называется возбуждённым. Оно неустойчиво. Время жизни возбуждённого атома составляет примерно 10-8 с, после чего атом возвращается в основное состояние, испуская один или несколько фотонов с суммарной энергией, равной энергии, полученной атомом при возбуждении. Таким образом, атомы поглощают и испускают энергию дискретными порциями (квантами), величина которых зависит от разности энергий электронов на электронных оболочках, между которыми происходит переход атомных электронов. Эти переходы принято отображать диаграммой энергетических переходов, пример которой представлен на рисунке 1.1.
 |
Рис. 1.1. Энергетические уровни атома и переходы между ними
Вертикальные стрелки между энергетическими уровнями показывают возможные переходы электронов в возбуждённом атоме с одних оболочек на свободные места в других оболочках. Количество возможных энергетических уровней в принципе может быть бесконечным, но на высоких уровнях энергия связи электронов с атомом становится настолько слабой, что они легко отрываются и становятся свободными электронами. Дискретность энергетических уровней атомов определяет и дискретный спектр излучаемых фотонов. В зависимости от уровня, на который переходят электроны возбуждённого атома, переходы делятся на серии, называемые по обозначениям этих уровней (что и показано на данной диаграмме). Дискретные (линейчатые) спектры фотонного излучения специфичны для различных элементов, что позволяет использовать их для анализа состава сложных веществ. Спектральный диапазон этих излучений простирается от инфракрасного до рентгеновского излучения.
Date: 2015-06-08; view: 1270; Нарушение авторских прав