
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Максвелл ввел понятие полного тока,равного сумме токов проводимости (а также конвекционных токов) и смещения.Плотность полного тока 17 page
|
|
Главное квантовое число n, согласно (223.3), определяет энергетические уровни электрона в атоме и может принимать любые целочисленные значения начиная с единицы:

Из решения уравнения Шредингера вытекает, что момент импульса (механический орбитальный момент) электрона квантуется, т. е. не может быть произвольным, а принимает дискретные значения, определяемые формулой
 (223.4)
(223.4)
где l — орбитальное квантовое число, которое при заданном n принимает значения
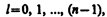 (223.5)
(223.5)
т. е. всего n значений, и определяет момент импульса электрона в атоме.
Из решения уравнений Шредингера следует также, что вектор L l момента импульса электрона может иметь лишь такие ориентации в пространстве, при которых его проекция Llx на направление z внешнего магнитного поля принимает квантованные значения, кратные ћ:
 (223.6)
(223.6)
где тl — магнитное квантовое число, которое при заданном l может принимать значения
 (223.7)
(223.7)
т. е. всего 2 l +1 значений. Таким образом, магнитное квантовое число ml определяет проекцию момента импульса электрона на заданное направление, причем вектор момента импульса электрона в атоме может иметь в пространстве 2 l +1 ориентации.
Наличие квантового числа ml должно привести в магнитном поле к расщеплению уровня с главным квантовым числом п на 2 l +1 подуровней. Соответственно в спектре атома должно наблюдаться расщепление спектральных линий. Действительно, расщепление энергетических уровней в магнитном поле было обнаружено в 1896 г. голландским физиком П. Зееманом (1865—1945) и получило название эффекта Зеемана. Расщепление уровней энергии во внешнем электрическом поле, тоже доказанное экспериментально, называется эффектом Штарка*.
* И. Штарк (1874—1957) — немецкий физик.
Хотя энергия электрона (223.3) и зависит только от главного квантового числа п, но каждому собственному значению Еn (кроме Е 1 ) соответствует несколько собственных функций  , отличающихся значениями l и ml. Следовательно, атом водорода может иметь одно и то же значение энергии, находясь в нескольких различных состояниях. Так как при данном п орбитальное квантовое число l может изменяться от 0 до п –1 (см. (223.5)), а каждому значению l соответствует 2 l +1 различных значений ml (223.7), то число различных состояний, соответствующих данному п, равно
, отличающихся значениями l и ml. Следовательно, атом водорода может иметь одно и то же значение энергии, находясь в нескольких различных состояниях. Так как при данном п орбитальное квантовое число l может изменяться от 0 до п –1 (см. (223.5)), а каждому значению l соответствует 2 l +1 различных значений ml (223.7), то число различных состояний, соответствующих данному п, равно
 (223.8)
(223.8)
Квантовые числа и их значения являются следствием решений уравнений Шредингера и условий однозначности, непрерывности и конечности, налагаемых на волновую функцию y. Кроме того, так как при движении электрона в атоме существенны волновые свойства электрона, то квантовая механика вообще отказывается от классического представления об электронных орбитах. Согласно квантовой механике, каждому энергетическому состоянию соответствует волновая функция, квадрат модуля которой определяет вероятность обнаружения электрона в единице объема.
Вероятность обнаружения электрона в различных частях атома различна. Электрон при своем движении как бы «размазан» по всему объему, образуя электронное облако, плотность (густота) которого характеризует вероятность нахождения электрона в различных точках объема атома. Квантовые числа п и l характеризуют размер и форму электронного облака, а квантовое число ml характеризует ориентацию электронного облака в пространстве.
В атомной физике, по аналогии со спектроскопией, состояние электрона, характеризующееся квантовыми числами l= 0, называют s -состоянием (электрон в этом состоянии называют s -электроном), l =1 — p -состоянием, l= 2 — d -состоянием, l =3 — f -состоянием и т. д. Значение главного квантового числа указывается перед условным обозначением орбитального квантового числа. Например, электроны в состояниях n =2 и l =0 и 1 обозначаются соответственно символами 2 s и 2 р.
На рис. 303 для примера приведено распределение электронной плотности (формы электронного облака) для состояний атома водорода при n =1 и п= 2, определяемое |  |2. Как видно из рисунка, оно зависит от n, l и ml. Так, при l =0 электронная плотность отлична от нуля в центре и не зависит от направления (сферически-симметрична), а для остальных состояний в центре равна нулю и зависит от направления.
|2. Как видно из рисунка, оно зависит от n, l и ml. Так, при l =0 электронная плотность отлична от нуля в центре и не зависит от направления (сферически-симметрична), а для остальных состояний в центре равна нулю и зависит от направления.
3. Спектр. Квантовые числа n, l и ml позволяют более полно описать спектр испускания (поглощения) атома водорода, полученный в теории Бора (см. рис. 294).
В квантовой механике вводятся правила отбора, ограничивающие число возможных переходов электронов в атоме, связанных с испусканием и поглощением света. Теоретически доказано и экспериментально подтверждено, что для дипольного излучения электрона, движущегося в центрально-симметричном поле ядра, могут осуществляться только такие переходы, для которых: 1) изменение орбитального квантового числа D l удовлетворяет условию
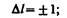 (223.9)
(223.9)
2) изменение магнитного квантового числа D ml удовлетворяет условию
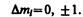
В оптических спектрах указанные правила отбора в основном выполняются. Однако в принципе могут наблюдаться и слабые «запрещенные» линии, например возникающие при переходах с D l = 2. Появление этих линий объясняется тем, что строгая теория, запрещая дипольные переходы, разрешает переходы, соответствующие излучению более сложных систем зарядов, например квадруполей. Вероятность же квадрупольных переходов (переходы с D l =2) во много раз меньше вероятности дипольных переходов, поэтому «запрещенные» линии и являются слабыми.
Учитывая число возможных состояний, соответствующих данному n, и правило отбора (223.9), рассмотрим спектральные линии атома водорода (рис. 304): серии Лаймана соответствуют переходы

серии Бальмера —

и т. д.

Переход электрона из основного состояния в возбужденное обусловлен увеличением энергии атома и может происходить только при сообщении атому энергии извне, например за счет поглощения атомом фотона. Так как поглощающий атом находится обычно в основном состоянии, то спектр атома водорода должен состоять из линий, соответствующих переходам 1 s®np (n = 2, 3,...), что находится в полном согласии с опытом.
§ 224. 1s-Состояние электрона в атоме водорода
1 s -Состояние электрона в атоме водорода является сферически-симметричным, т. е. не зависит от углов q и j. Волновая функция y электрона в этом состоянии определяется только расстоянием r электрона от ядра, т. е. y = y 100(r), где цифры в индексе соответственно указывают, что п= 1, l= 0 и ml =0. Уравнению Шредингера для 1 s -состояния электрона в атоме водорода удовлетворяет функция вида
 (224.1)
(224.1)
где, как можно показать,  — величина, совпадающая с первым боровским радиусом а (см. (212.2)) для атома водорода, С — некоторая постоянная, определяемая из условия нормировки вероятностей (216.3).
— величина, совпадающая с первым боровским радиусом а (см. (212.2)) для атома водорода, С — некоторая постоянная, определяемая из условия нормировки вероятностей (216.3).
Благодаря сферической симметрии y -функции вероятность обнаружения электрона на расстоянии r одинакова по всем направлениям. Поэтому элемент объема d V, отвечающий одинаковой плотности вероятности, обычно представляют в виде объема сферического слоя радиусом r и толщиной d r: d V =4p r 2d r. Тогда, согласно условию нормировки вероятностей (216.3) с учетом (224.1),

После интегрирования получим
 (224.2)
(224.2)
Подставив выражение (224.2) в формулу (224.1), определим нормированную волновую функцию, отвечающую 1 s -состоянию электрона в атоме водорода:
 (224.3)
(224.3)
Вероятность обнаружить электрон в элементе объема (см. (216.2)) равна

Подставив в эту формулу волновую функцию (224.3), получим
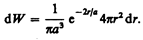
Вычислим те расстояния r max от ядра, на которых электрон может быть обнаружен с наибольшей вероятностью. Исследуя выражение d W/ d r на максимум, получим, что r max= a. Следовательно, электрон может быть обнаружен с наибольшей вероятностью на расстояниях, равных боровскому радиусу, т. е. имеется равная и наибольшая вероятность обнаружения электрона во всех точках, расположенных на сферах радиуса а с центром в ядре атома. Казалось бы, квантово-механический расчет дает полное согласие с теорией Бора. Однако, согласно квантовой механике, плотность вероятности лишь при r=а достигает максимума, оставаясь отличной от нуля во всем пространстве (рис. 305). Таким образом, в основном состоянии атома водорода наиболее вероятным расстоянием от электрона до ядра является расстояние, равное боровскому радиусу. В этом заключается квантово-механический смысл боровского радиуса.

§ 225. Спин электрона. Спиновое квантовое число
О. Штерн и В. Герлах, проводя прямые измерения магнитных моментов (см. § 131), обнаружили в 1922 г., что узкий пучок атомов водорода, заведомо находящихся в s -состоянии, в неоднородном магнитном поле расщепляется на два пучка. В этом состоянии момент импульса электрона равен нулю (см. (223.4)). Магнитный момент атома, связанный с орбитальным движением электрона, пропорционален механическому моменту (см. (131.3)), поэтому он равен нулю и магнитное поле не должно оказывать влияния на движение атомов водорода в основном состоянии, т. е. расщепления быть не должно. Однако в дальнейшем при применении спектральных приборов с большой разрешающей способностью было доказано, что спектральные линии атома водорода обнаруживают тонкую структуру (являются дублетами) даже в отсутствие магнитного поля.
Для объяснения тонкой структуры спектральных линий, а также ряда других трудностей в атомной физике американские физики Д. Уленбек (1900—1974) и С. Гаудсмит (1902—1979) предположили, что электрон обладает собственным неуничтожимым механическим моментом импульса, не связанным с движением электрона в пространстве, спином (см. §131).
Спин электрона (и всех других микрочастиц) — квантовая величина, у нее нет классического аналога; это внутреннее неотъемлемое свойство электрона, подобное его заряду и массе.
Если электрону приписывается собственный механический момент импульса (спин) L s, то ему соответствует собственный магнитный момент р ms. Согласно общим выводам квантовой механики, спин квантуется по закону
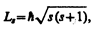
где s — спиновое квантовое число.
По аналогии с орбитальным моментом импульса, проекция Lsz спина квантуется так, что вектор L s может принимать 2 s +1 ориентации. Так как в опытах Штерна и Герлаха наблюдались только две ориентации, то 2 s +1=2, откуда s = ½. Проекция спина на направление внешнего магнитного поля, являясь квантованной величиной, определяется выражением, аналогичным (223.6):

где тs — магнитное спиновое квантовое число; оно может иметь только два значения: ms = ± ½.
Таким образом, опытные данные привели к необходимости характеризовать электроны (и микрочастицы вообще) добавочной внутренней степенью свободы. Поэтому для полного описания состояния электрона в атоме необходимо наряду с главным, орбитальным и магнитным квантовыми числами задавать еще магнитное спиновое квантовое число.
§ 226. Принцип неразличимости тождественных частиц. Фермионы и бозоны
Если перейти от рассмотрения движения одной микрочастицы (одного электрона) к многоэлектронным системам, то проявляются особые свойства, не имеющие аналога в классической физике. Пусть квантово-механическая система состоит из одинаковых частиц, например электронов. Все электроны имеют одинаковые физические свойства — массу, электрический заряд, спин и другие внутренние характеристики (например, квантовые числа). Такие частицы называют тождественными.
Необычные свойства системы одинаковых тождественных частиц проявляются в фундаментальном принципе квантовой механики — принципе неразличимости тождественных частиц, согласно которому невозможно экспериментально различить тождественные частицы.
В классической механике даже одинаковые частицы можно различить по положению в пространстве и импульсам. Если частицы в какой-то момент времени пронумеровать, то в следующие моменты времени можно проследить за траекторией любой из них. Классические частицы, таким образом, обладают индивидуальностью, поэтому классическая механика систем из одинаковых частиц принципиально не отличается от классической механики систем из различных частиц.
В квантовой механике положение иное. Из соотношения неопределенностей вытекает, что для микрочастиц вообще неприменимо понятие траектории; состояние микрочастицы описывается волновой функцией, позволяющей вычислять лишь вероятность (| y |2) нахождения микрочастицы в окрестностях той или иной точки пространства. Если же волновые функции двух тождественных частиц в пространстве перекрываются, то разговор о том, какая частица находится в данной области, вообще лишен смысла: можно лишь говорить о вероятности нахождения в данной области одной из тождественных частиц. Таким образом, в квантовой механике тождественные частицы полностью теряют свою индивидуальность и становятся неразличимыми. Следует подчеркнуть, что принцип неразличимости тождественных частиц не является просто следствием вероятностной интерпретации волновой функции, а вводится в квантовую механику как новый принцип, который, как уже указывалось, является фундаментальным.
Принимая во внимание физический смысл величины | y |2, принцип неразличимости тождественных частиц можно записать в виде
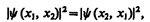 (226.1)
(226.1)
где x 1 и х 2 — соответственно совокупность пространственных и спиновых координат первой и второй частиц. Из выражения (226.1) вытекает, что возможны два случая:
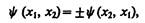
т. е. принцип неразличимости тождественных частиц ведет к определенному свойству симметрии волновой функции. Если при перемене частиц местами волновая функция не меняет знака, то она называется cимметричной, если меняет — антисимметричной. Изменение знака волновой функции не означает изменения состояния, так как физический смысл имеет лишь квадрат модуля волновой функции. В квантовой механике доказывается, что характер симметрии волновой функции не меняется со временем. Это же является доказательством того, что свойство симметрии или антисимметрии — признак данного типа микрочастиц.
Установлено, что симметрия или антисимметрия волновых функций определяется спином частиц. В зависимости от характера симметрии все элементарные частицы и построенные из них системы (атомы, молекулы) делятся на два класса. Частицы с полуцелым спином (например, электроны, протоны, нейтроны) описываются антисимметричными волновыми функциями и подчиняются статистике Ферми — Дирака; эти частицы называются фермионами. Частицы с нулевым или целочисленным спином (например, p-мезоны, фотоны) описываются симметричными волновыми функциями и подчиняются статистике Бозе — Эйнштейна; эти частицы называются бозонами. Сложные частицы (например, атомные ядра), составленные из нечетного числа фермионов, являются фермионами (суммарный спив — полуцелый), а из четного — бозонами (суммарный спин целый).

Зависимость характера симметрии волновых функций системы тождественных частиц от спина частиц теоретически обоснована швейцарским физиком В. Паули (1900—1958), что явилось еще одним доказательством того, что спин является фундаментальной характеристикой микрочастиц.
§ 227. Принцип Паули. Распределение электронов в атоме по состояниям
Если тождественные частицы имеют одинаковые квантовые числа, то их волновая функция симметрична относительно перестановки частиц. Отсюда следует, что два одинаковых фермиона, входящих в одну систему, не могут находиться в одинаковых состояниях, так как для фермионов волновая функция должна быть антисимметричной. Обобщая опытные данные, В. Паули сформулировал принцип, согласно которому системы фермионов встречаются в природе только в состояниях, описываемых антисимметричными волновыми функциями (квантово-механическая формулировка принципа Паули).
Из этого положения вытекает более простая формулировка принципа Паули, которая и была введена им в квантовую теорию (1925) еще до построения квантовой механики: в системе одинаковых фермионов любые два из них не могут одновременно находиться в одном и том же состоянии. Отметим, что число однотипных бозонов, находящихся в одном и том же состоянии, не лимитируется.
Напомним, что состояние электрона в атоме однозначно определяется набором четырех квантовых чисел:
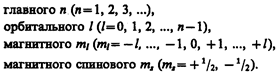
Распределение электронов в атоме подчиняется принципу Паули, который может быть использован в его простейшей формулировке: в одном и том же атоме не может быть более одного электрона с одинаковым набором четырех квантовых чисел п, l, ml и тs т. е.

где Z (п, l, ml, тs) — число электронов, находящихся в квантовом состоянии, описываемом набором четырех квантовых чисел: п, l, ml, тs. Таким образом, принцип Паули утверждает, что два электрона, связанные в одном и том же атоме, различаются значениями по крайней мере одного квантового числа.
Согласно формуле (223.8), данному n соответствует n 2 различных состояний, отличающихся значениями l и ml. Квантовое число тs может принимать лишь два значения (± ½). Поэтому максимальное число электронов, находящихся в состояниях, определяемых данным главным квантовым числом, равно

Совокупность электронов в многоэлектронном атоме, имеющих одно и то же главное квантовое число n, называют электронной оболочкой. В каждой из оболочек электроны распределяются по подоболочкам, соответствующим данному l. Поскольку орбитальное квантовое число принимает значения от 0 до n –1, число подоболочек равно порядковому номеру n оболочки. Количество электронов в подоболочке определяется магнитным и магнитным спиновым квантовыми числами: максимальное число электронов в подоболочке с данным l равно 2(2 l +1). Обозначения оболочек, а также распределение электронов по оболочкам и подоболочкам представлены в табл. 6.
Таблица 6

§ 228. Периодическая система элементов Менделеева
Принцип Паули, лежащий в основе систематики заполнения электронных состояний в атомах, позволяет объяснить Периодическую систему элементов Д. И. Менделеева (1869) — фундаментального закона природы, являющегося основой современной химии, атомной и ядерной физики.
Д. И. Менделеев ввел понятие порядкового номера Z химического элемента, равного числу протонов в ядре и соответственно общему числу электронов в электронной оболочке атома. Расположив химические элементы по мере возрастания порядковых номеров, он получил периодичность в изменении химических свойств элементов. Однако для известных в то время 64 химических элементов некоторые клетки таблицы оказались незаполненными, так как соответствующие им элементы (например, Ga, Se, Ос) тогда еще не были известны. Д. И. Менделеев, таким образом, не только правильно расположил известные элементы, но и предсказал существование новых, еще не открытых элементов и их основные свойства. Кроме того, Д. И. Менделееву удалось уточнить атомные веса некоторых элементов. Например, атомные веса Be и U, вычисленные на основе таблицы Менделеева, оказались правильными, а полученные ранее экспериментально — ошибочными.
Так как химические и некоторые физические свойства элементов объясняются внешними (валентными) электронами в атомах, то периодичность свойств химических элементов должна быть связана с определенной периодичностью в расположении электронов в атомах. Поэтому для объяснения таблицы будем считать, что каждый последующий элемент образован из предыдущего прибавлением к ядру одного протона и соответственно прибавлением одного электрона в электронной оболочке атома. Взаимодействием электронов пренебрегаем, внося, где это необходимо, соответствующие поправки. Рассмотрим атомы химических элементов, находящиеся в основном состоянии.
Единственный электрон атома водорода находится в состоянии 1 s, характеризуемом квантовыми числами п= 1, l= 0, ml =0 и ms =± ½; (ориентация его спина произвольна). Оба электрона атома Не находятся в состоянии 1 s, но с антипараллельной ориентацией спина. Электронная конфигурация для атома Не записывается как 1 s 2(два 1 s -электрона). На атоме Не заканчивается заполнение K -оболочки, что соответствует завершению I периода Периодической системы элементов Менделеева (табл. 7).
Таблица 7

Третий электрон атома Li (Z =3), согласно принципу Паули, уже не может разместиться в целиком заполненной K -оболочке и занимает наинизшее энергетическое состояние с n =2 (L -оболочка), т.е. 2 s -состояние. Электронная конфигурация для атома Li: 1 s 22 s. Атомом Li начинается II период Периодической системы элементов. Четвертым электроном Be (Z =4) заканчивается заполнение подоболочки 2 s. У следующих шести элементов от В (Z= 5 ) до Ne (Z= 10) идет заполнение подоболочки 2 р (табл. 7). II период Периодической системы заканчивается неоном — инертным газом, для которого подоболочка 2 р целиком заполнена.
Одиннадцатый электрон Na (Z =11) размещается в М -оболочке (n =3), занимая наинизшее состояние 3 s. Электронная конфигурация имеет вид 1 s 22 s 22 p 63 s. 3 s -Электрон (как и 2 s -электрон Li) является валентным электроном, поэтому оптические свойства Na подобны свойствам Li. С Z= 12 идет последовательное заполнение M -оболочки. Аr (Z =18) оказывается подобным Не и Ne: в его наружной оболочке все s- и p -состояния заполнены. Аr является химически инертным и завершает III период Периодической системы.
Девятнадцатый электрон К (Z =19) должен был бы занять 3 d -состоянис в M -оболочке. Однако и в оптическом, и в химическом отношениях атом К схож с атомами Li и Na, которые имеют внешний валентный электрон в s -состоянии. Поэтому 19-й валентный электрон К должен также находиться в s -состоянии, но это может быть только s -состояние новой оболочки (N -оболочки), т. е. заполнение N -оболочки для К начинается при незаполненной M -оболочке. Это означает, что в результате взаимодействия электронов состояние n =4, l =0 имеет меньшую энергию, чем состояние n =3, l= 2. Спектроскопические и химические свойства Са (Z =20) показывают, что его 20-й электрон также находится в 4 s -состоянии N -оболочки. В последующих элементах происходит заполнение M -оболочки (от Sc (Z= 21) до Zn (Z =30)). Далее N -оболочка заполняется до Кr (Z =36), у которого опять-таки, как и в случае Ne и Аr,
s- и p -состояния наружной оболочки заполнены целиком. Криптоном заканчивается IV период Периодической системы. Подобные рассуждения применимы и к остальным элементам таблицы Менделеева, однако эти данные можно найти в справочниках. Отметим лишь, что и начальные элементы последующих периодов Rb, Cs, Fr являются щелочными металлами, а их последний электрон находится в s -состоянии. Кроме того, атомы инертных газов (Не, Ne, Ar, Кr, Хе, Rn) занимают в таблице особое положение — в каждом из них s - и p- состояния наружной оболочки целиком заполнены и ими завершаются очередные периоды Периодической системы.
Каждую из двух групп элементов — лантаниды (от лантана (Z =57) до лютеция (Z =71)) и актиниды (от актиния (Z =89) до лоуренсия (Z =103)) — приходится помещать в одну клетку таблицы, таккак химические свойства элементов в пределах этих групп очень близки. Это объясняется тем, что для лантанидов заполнение подоболочки 4 f, которая может содержать 14 электронов, начинается лишь после того, как целиком заполнятся подоболочки 5 s, 5 p и 6 s. Поэтому для этих элементов внешняя P -оболочка (6 s 2) оказывается одинаковой. Аналогично, одинаковой для актинидов является Q -оболочка (7 s 2).
Таким образом, открытая Менделеевым периодичность в химических свойствах элементов объясняется повторяемостью в структуре внешних оболочек у атомов родственных элементов. Так, инертные газы имеют одинаковые внешние оболочки из 8 электронов (заполненные s- и p -состояния); во внешней оболочке щелочных металлов (Li, Na, К, Rb, Cs, Fr) имеется лишь один s -электрон; во внешней оболочке щелочноземельных металлов (Be, Mg, Ca, Sr, Ba, Ra) имеется два s -электрона; галоиды (F, О, Br, I, At) имеют внешние оболочки, в которых недостает одного электрона до оболочки инертного газа, и т. д.

§ 229. Рентгеновские спектры
Большую роль в выяснении строения атома, а именно распределения электронов по оболочкам, сыграло излучение, открытое в 1895 г. немецким физиком В. Рентгеном (1845—1923) и названное рентгеновским. Самым распространенным источником рентгеновского излучения является рентгеновская трубка, в которой сильно ускоренные электрическим полем электроны бомбардируют анод (металлическая мишень из тяжелых металлов, например W или Pt), испытывая на нем резкое торможение. При этом возникает рентгеновское излучение, представляющее собой электромагнитные волны с длиной волны примерно 10–12—10–8 м. Волновая природа рентгеновского излучения доказана опытами по его дифракции, рассмотренными в § 182.
Исследование спектрального состава рентгеновского излучения показывает, что его спектр имеет сложную структуру (рис. 306) и зависит как от энергии электронов, так и от материала анода. Спектр представляет собой наложение сплошного спектра, ограниченного со стороны коротких длин волн некоторой границей lmin, называемой границей сплошного спектра, и линейчатого спектра — совокупности отдельных линий, появляющихся на фоне сплошного спектра.
Date: 2015-11-15; view: 351; Нарушение авторских прав