
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Расчет рабочей массы топлива. Точный расчет процесса горения топлива на основе физико-химических закономерностей возможен только для случая полного горения при стехиометрических
|
|
Точный расчет процесса горения топлива на основе физико-химических закономерностей возможен только для случая полного горения при стехиометрических соотношениях топлива и окислителя. На практике же горение топлива происходит с коэффициентом расхода воздуха n, отличным от 1, и существенно зависит от качества перемешивания компонентов горения - топлива и воздуха.
Целью расчета горения топлива является определение теплоты его сгорания, необходимого количества воздуха для полного горения, количества, состава и плотности продуктов горения, теоретической и действительной температуры горения.
Твердые и жидкие топлива состоят из углеводородов сложного состава и балласта (золы и влаги). Химический состав их обычно представляют поэлементно: C - углерод, H - водород, O - кислород, N - азот и горючая сера – S = SОР + SК, состоящая из органической и колчеданной серы.
В топливе различают органическую, горючую, сухую и рабочую массы.
Газовое топливо состоит из горючей массы - газов CO, H2, H2S, углеводородов CH4, C2H4, C2H6, C3H8 и т.д. и балласта CO2, N2, SO2, H2О.
Расчет горения жидкого и твердого топлива проводится по рабочей массе. Для пересчета составов из одной массы в другую пользуются коэффициентами-множителями (табл. 1), на которые необходимо умножить содержание того или иного компонента топлива в одной массе для того, чтобы получить содержание этого же компонента в другой.
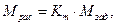 (1)
(1)
где Mрас - рассчитываемая масса компонента топлива;
Mзад - заданная масса компонента топлива;
Кm - коэффициент-множитель пересчета одного вида массы
топлива в другой.
Таблица 1
Коэффициенты-множители Кm для пересчета состава
твердого и жидкого топлива на различные массы
| Заданная масса топлива | Масса топлива, на которую ведется пересчет | |||
| Рабочая | Сухая | Горючая | Органическая | |
| Рабочая | __100__ 100–WР | ___100__ 100–AР–WР | _____100____ 100–SР–AР–WР | |
| Сухая | 100–WP | __100__ 100–AС | _____100____ 100–SС–AС | |
| Горючая | 100–AР–WР | 100–AС | _100_ 100–SГ | |
| Органическая | 100–SР–AР–WР | 100–SC–AС | 100–SГ |
Газообразные топлива рассчитываются с учетом содержания в них водяных паров, определяемых по влагосодержанию газа dГ, г/м3.
Для коксового и доменного газов эта величина может быть определена при условии насыщения для соответствующей температуры газа по прил. 1.
Для природного газа dГ принимается равным 8…10 г/м3. Содержание H2O во влажном газе может быть определено по формуле
 (2)
(2)
где  - содержание водяных паров во влажном газе, %;
- содержание водяных паров во влажном газе, %;
dГ - влагосодержание в граммах отнесенное к одному
кубическому метру сухого газа, г/м3. По полученному значению содержания водяных паров в газе определяется коэффициент пересчета Кв состава газа с сухого на влажный (рабочий состав).
 (3)
(3)
Пересчет состава газа с сухого на влажный производится по формуле
 (4)
(4)
где  - содержание компонента во влажном газе, %;
- содержание компонента во влажном газе, %;
 - содержание компонента в сухом газе, %;
- содержание компонента в сухом газе, %;
Кв - коэффициент пересчета на влажный газ.
Пересчету подвергаются все компоненты газа, включая балластные составляющие.
Date: 2015-11-13; view: 401; Нарушение авторских прав