
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Методичні вказівки
|
|
Актуальність теми
Основним завданням практикуму є засвоєння, закріплення і творчий
розчиток теоретичних знань, одержаних під час лекцій і самостійних занять,
вміння працювати з літературою, вироблення певних практичних навичок та
умінь для прийняття обгрунтованих рішень для розв’язування різних
задач. Сьогодні відомо десятки тисяч неорганічних
речовин, які поділяють на 4 основні класи – оксиди, гідроксиди, кислоти,
солі. Номенклатуру хімічних сполук називають «мовою хімії», що вказує на
важливість цього розділу для засвоєння основ загальної хімії та інших
хімічних дисциплін.
Мета: узагальнити і систематизувати знання студентів про основні класи неорганічних сполук, будову періодичної системи хімічних елементів і періодичний закон Д. І. Мендєлєева, навчити застосовувати одержані знання під час розв’язування задач з використанням основних положень та законів хімії, вміти характеризувати хімічні елементи за будовою атома згідно періодичного закону Д.І. Менделєєва.
Базові поняття та терміни: електронна будова атома,молекула, йон, моль, хімічний елемент,ізобари, група, радіоактивність, ізотопи, основи, кислоти, солі.
План.
1. Основні класи неорганічних сполук: кислоти, основи, гідроксиди, солі.
2. Основні поняття Періодичної системи Д.І. Менделєєва.
3. Хімічний зв’язок та будова речовини.
4. Розв’язування задач із застосуванням фундаментальних законів хімії.
Рекомендована література
1. Хомченко, І. Г.. Загальна хімія: підручник / I. Г. Хомченко; пер. М. Д. Михайлова. - Київ: Вища шк., 1993. - 424 с.
2. Рейтер, Л. Г.. Теоретичні розділи загальної хімії: навчальний посібник для студ. вузів / Л.Г. Рейтер, О.М. Степаненко, В.П. Басов. - К.: Каравела, 2003. - 344 с.
3. Телегус В. С., Бодак О. І., Основи загальної хімії - Л.: Світ, 1998. - 423 с.
4. Тимченко О. В. Використання алгоритмів під час розв’язування розрахункових задач з хімії. Хімія. Видавнича группа «Основа» №2 (230) січень 2011
Методичні вказівки.

Vm — молярний об’єм газу, за н. у. 22,4 л/моль,
NA — число Авоґадро, 6,02 • 1023 моль–1,
R — універсальна газова стала, 8,31 Дж/К,
Ar — відносна атомна маса,
Mr — відносна молекулярна маса.
Приклади розв’язання типових задач:
Задача 1: Який об’єм займають 1,2 1024 молекул діоксиду вуглецю (II) за нормальних умов?
Розв’язання. Використовуємо формулу

і розрахуємо об’єм газу:
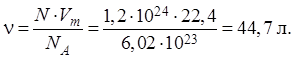
Отже, об’єм газу дорівнює 44,7 л.
Задача 2: Визначіть відносну молекулярну масу газу, якщо густина його по гідрогену дорівнює 22.
Рішення:
Так як молекулярна маса гідрогену» 2 г/моль, то М1 =М(Н2) × D(Н2) = 2 × 22 = 44 г/моль.
Задача 3: Скласти електронну формулу та графічну схему елемента № 21.
По періодичній таблиці визначаємо, що елемент № 21 – Скандій. Він знаходиться в 4 періоді, 4 ряду, ІІІ групі, побічній підгрупі. Порядковий номер його 21, отже, заряд ядра + 21, а електронна оболонка складається з 21 електрона. Кількість електронних шарів відповідає номеру періода, в якому знаходиться елемент. Отже, в атомі Скандія 4 електронних шара.
 +21))))
+21))))
2 8 9 2
1s2 2s2 2p6 3s2 3p6 4s2 3d1
Cпочатку заповнюється 3 d орбіталь, тому що значення її головного квантового числа менше, ніж на 4р орбіталі:
3d n =3 1 = 2 n + 1 = 5
4р n = 4 1 = 1 n + 1 = 5
Графічна схема
 |










 4s2 ¯
4s2 ¯





 3s23p63d1 ¯ ¯ ¯ ¯
3s23p63d1 ¯ ¯ ¯ ¯


 2s22p6 ¯ ¯ ¯ ¯
2s22p6 ¯ ¯ ¯ ¯
 1s2 ¯
1s2 ¯
Для складання формул сполук з різним типом хімічного зв’язку слід згадати, що існують слідуючі типи хімічних зв’язків:
- іонний - зв’язок, який виникає за рахунок електростатичного притягання іонів (іони – заряджені частинки);
- ковалентний (полярний та неполярний) - зв’язок, який виникає за допомогою електронних пар;
- металічний.
Date: 2015-12-11; view: 630; Нарушение авторских прав