
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Вывод рабочей формулы
|
|
Рассмотрим метод Клемана – Дезорма. Напустим воздух в стеклянный сосуд 1 (см. рисунок) т.е. откроем и закроем кран 10. При быстром сжатии температура воздуха повышается. Поэтому после прекращения напуска разность уровней жидкости в манометре будет постепенно уменьшаться, пока температура воздуха внутри сосуда не сравняется с температурой окружающего воздуха. Назовем состояние воздуха в сосуде после выравнивания температур состоянием 1. Параметры состояния 1: V 1 - объем единицы массы воздуха; t 1 - температура воздуха; р1 - давление в сосуде.
Откроем кран 3и, как только давление в сосуде сравняется с атмосферным, закроем его. Так как расширение происходит очень быстро, то процесс близок к адиабатическому и, следовательно, температура понизится до t 2. Объем единицы массы воздуха станет равным V 2. Воздух, оставшийся в сосуде, перейдет в состояние 2 с параметрами V 2, t 2, р2 (р2 –атмосферное давление). Так как температура t 2 меньше наружной, то воздух в сосуде будет постепенно нагреваться (вследствие теплообмена с окружающей средой) до температуры окружающего воздуха t1. Это нагревание происходит изохорически, так как кран закрыт. Давление воздуха в сосуде увеличивается по сравнению с атмосферным, и в манометре возникает разность уровней h 2, т.е. воздух переходит в состояние 3 с параметрами V 2, t 1, р3.
Таким образом, мы имеем три состояния газа со следующими параметрами:
| Состояние Параметр | |||
| Объем | V 1 | V 2 | V 2 |
| Температура | t 1 | t 2 | t 1 |
| Давление | p 1 | p2 | p 3 |
В состояниях 1 и 3 воздух имеет одинаковую температуру, следовательно, параметры этих состояний можно связать уравнением изотермического процесса (уравнением Бойля – Мариотта):
 или
или  (4)
(4)
Переход от состояния 1 к состоянию 2 происходит адиабатически, поэтому параметры их связаны уравнением Пуассона (3):
 или
или  (5)
(5)
Из уравнений (4) и (5) получим
 (6)
(6)
Прологарифмировав равенство (6), получим
 , (7)
, (7)
Если давление измерять жидкостным манометром, то вместо р можно писать соответствующую высоту жидкости. Тогда можно ввести обозначения

где H – атмосферное давление, h1 – разность уровней манометра в первом состоянии, h2 – разность уровней в третьем состоянии.
Тогда выражение (7) можно переписать в виде

Так как величины h 1 и h 2, выраженные в миллиметрах ртутного столба, очень малы по сравнению с Н и, следовательно, дроби h 1/ H и (h 1 - h 2)/(H + h 2) также незначительны, для нахождения величины логарифма можно воспользоваться приближенным выражением
 ,
,
где х - малая величина.
Поскольку х 2 и, тем более, х 3 - величины высших порядков малости, ими можно пренебречь, тогда lg(1+ x) @ x и, следовательно,

Пренебрегая величиной h 2 в сумме H + h 2, получим расчетную формулу
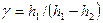 . (8)
. (8)
Date: 2015-10-19; view: 802; Нарушение авторских прав