
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

И гидроксидов
|
|
Основания и кислородсодержащие кислоты содержат связь R-ОН, где R – атом элемента или атом, к которому присоединены другие группы (например, NH4+, СН3СОО-).
Различают основной и кислотный тип диссоциации:
ROH «R++ OH-(основной тип диссоциации);
НОR«H+ + RO- (кислотный тип диссоциации).
При электролитической диссоциации происходит разрыв связей с наибольшей степенью ионности. Чем больше разность относительных электроотрицательностей (ОЭО) элементов, образующих связь, тем сильнее связь поляризована, т.е. тем большую степень ионности она имеет и тем легче происходит диссоциация на ионы. Например, в соединении NaOH разность ОЭО кислорода и натрия (DОЭОO-Na) равна:
3,5–0,9 = 2,6.
Разность ОЭО кислорода и водорода (DОЭОО-Н) равна:
3,5–2,1 = 1,4.
Степень ионности связи Na-О больше, чем у связи О-Н. Поэтому NaOH диссоциирует по основному типу и является типичным основанием: NaOH= Na++ OH-.
В соединении HClO4:
DОЭОО-Сl = 3,5–3,0 = 0,5; DОЭОО-Н = 3,5–2,1 = 1,4.
Степень ионности связи Cl-O меньше, чем связи О-Н. Соединение HClO диссоциируетпо кислотному типу и является типичной кислотой: HClO4 = H++ ClO4-.
Если степени ионности связей О-R и О-Н сравнимы по величине, то электролиты проявляют свойства и кислоты, и основания, т.е. имеют двойственный характер диссоциации. В нейтральной среде у таких электролитов устанавливается сложное равновесие:
| H++ RO- | « | R-O-H | « | R++ OH- |
| кислотный тип диссоциации | основной тип диссоциации |
Основаниями (гидроксидами) с точки зрения электролитической диссоциации называются электролиты, которые в качестве анионов образуют только анионы гидроксила ОН-. Например:
NaOH = Na++ OH-.
NH4 ОН «NH4++ OH-.
Основания многовалентных металлов диссоциируют ступенчато, а значит, такие гидроксиды будут иметь несколько констант диссоциации.
Например: Ba(OH)2 «BaOH++ OH- (1-я ступень),
ВаОН+«Ва2++ ОН- (2-я ступень).
Кислотами, с точки зрения электролитической диссоциации, называются электролиты, которые в качестве катионов образуют только катионы водорода Н+. Например:
HNO3 = H++ NO3-.
CH3COOH «H++ CH3COO-.
Многоосновные слабые кислоты диссоциируют ступенчато. Например: H3РO4 «H++ H2РO4- (1-я ступень)

H2РO4- «H++ HРO42- (2-я ступень),

HРO42-«H++ РO43- (3-я ступень),
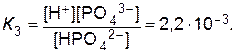
Всегда К1>К2>К3, т.е. многоосновная кислота при диссоциации по первой ступени ведет себя как более сильная кислота, чем по второй и третьей.
Амфотерные электролиты с точки зрения электролитической диссоциации участвуют в сложных ионных равновесиях, в которых образуются и катионы водорода, и анионы гидроксила,т.е. амфотерные электролиты в водных растворах в зависимости от характера среды могут диссоциировать как по типу основания, так и по типу кислоты.
Например, гидроксид цинка диссоциирует в кислой среде по типу основания:
Zn(OH)2 «ZnOH+ + OH- «Zn2+ + 2OH-,
а в щелочной среде – по типу кислоты:
H2ZnO2 «H++ HZnO2- «2H++ ZnO22-.
К амфотерным электролитам относятся: гидроксид цинка Zn(OH)2; гидроксид свинца Pb(OH)2; гидроксид олова Sn(OH)2; гидроксид аллюминия Al(OH)3; гидроксид хрома Cr(OH)3 и др.
Солями с точки зрения электролитической диссоциации, называются электролиты, которые диссоциируют с образованием катионов металла (или аммония NH4+) и анионов кислотного остатка.
Например:
NaNO3 = Na++ NO3-,
CaCl2 =Ca2++ 2Cl-,
K3PO4 = 3К+ + РО43-,
NH4Cl= NH4+ + Cl-.
Кислые соли (продукты неполного замещения атомов водорода кислоты на металл) диссоциируют по ступеням. Например:
NaHCO3 = Na++ HCO3- (1-я ступень),
HCO3- «H++ CO32- (2-я ступень).
Основные соли (продукты неполного замещения гидроксильной группы основания на кислотный остаток) также диссоциируют по ступеням:
Mg(OH)Cl = Mg(OH)+ + Cl- (1-я ступень),
Mg(OH)+ «Mg2+ + OH- (2-я ступень).
Date: 2015-10-19; view: 800; Нарушение авторских прав