
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Каталитические реакции
|
|
Катализаторы – вещества, изменяющие скорость реакции и остающиеся к концу реакции химически неизменными.
Явление изменения скорости реакции под действием таких веществ называется катализом.
Сущность каталитического действия.
Катализ обусловлен промежуточным химическим взаимодействием реагирующих веществ с катализатором, в результате которого открывается новый реакционный путь. Ускорение процессов с помощью катализаторов достигается за счет того, что появляются новые механизмы, при которых медленные стадии заменяются более быстрыми.
Реакция превращения веществ А и В в вещество АВ с участием катализатора К осуществляется по следующей схеме:
A + K ® AK
AK + B ® AB + K
A + B ® AB.
Независимо от механизма действия роль катализатора с точки зрения энергетики реакции сводится, как показано на рис. 4.6, кснижению энергии активации (Е а кат < Е а ), за счет чего увеличивается константа скорости реакции.

Рис.4.6. Реакция с участием катализатора
Катализатор может также способствовать необходимой для взаимодействия молекул ориентации. Катализатор не влияет на константу химического равновесия и не смещает положение химического равновесия. Энергия активации прямой и обратной реакций при введении катализатора уменьшается на одинаковую величину. Катализатор ускоряет прямую и обратную реакции, т.е. сокращает время достижения равновесия при подходе к нему как со стороны исходных веществ, так и со стороны продуктов.
По фазовому принципу различают гомогенный и гетерогенный катализ.
Гомогенный катализ. Гомогенным называют катализ, при котором катализатор и реагирующие вещества находятся в одной фазе (газовой или жидкой). Примером гомогенногогазофазного каталитического процесса может служить окисление диоксида серы SO2 до триоксида SO3. Без катализатора диоксид серы очень медленно окисляется кислородом.
При производстве серной кислоты камерным способом процесс окисления диоксида серы до триоксида катализируется оксидом азота (II), который открывает для реакции новый путь, не включающий медленной стадии взаимодействия диоксида серы с молекулярным кислородом
2SO2(г) + О2(г) 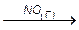 2SO3(г).
2SO3(г).
Катализатор NO вступает в реакцию с кислородом О2 , образуя промежуточный продукт NO2:
2NO(г) + O2(г) = 2NO2(г).
NO2 затем реагирует с SO2 по реакции
2SO2(г) + 2NO2(г) = 2SO3(г) + 2NO(г),
в результате которой получается конечный продукт и выделяется катализатор в химически неизменном виде и первоначальном количестве.
К преимуществам гомогенного катализа можно отнести высокую эффективность действия катализаторов, так как реакция идет во всем объеме сосуда. Но практическое выделение продуктов из реакционной смеси может быть затруднено.
Гетерогенный катализ. Гетерогенным называют катализ, при котором катализатор и реагирующие вещества находятся в разных фазах. Процесс идет на границе раздела фаз. Обычно в качестве катализатора используется твердое вещество и взаимодействие протекает на его поверхности, а реагенты находятся в газовой или жидкой фазах. Активность гетерогенного катализатора зависит от величины и свойств его поверхности. Обычно применяют тонко измельченные порошки, пористые структуры с высокоразвитой поверхностью, в том числе пористые носители с нанесенным слоем катализатора.
Во многих случаях гетерогенный катализ протекает с помощью переходных металлов и их соединений (Pt, Pd, Rh, Fe, Ni, CuO, V2O5, NiO, Fe2O3, Cr2O3 и др.).
Примером гетерогенного катализа является вышерассмотренная реакция окисления диоксида серы SO2 до триоксида SO3, но уже в присутствии твердого катализатора V2O5 или Pt
2SO2(г) + O2(г) 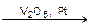 2SO3(г).
2SO3(г).
Гетерогенный катализ удобен тем, что катализатор не смешивается с реагентами, поэтому не возникает проблемы отделения его от продуктов реакции. Но с течением времени активная поверхность твердых катализаторов может измениться.
Date: 2015-10-19; view: 766; Нарушение авторских прав