
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Ковалентная связь. Метод валентных связей
|
|
Основные положения метода валентных связей:
– химическая связь между двумя атомами возникает в результате перекрывания атомных орбиталей (АО) с образованием электронных пар (обобществления двух электронов);
– энергия обмена электронами между атомами (в результате перекрывания орбиталей) вносит основной вклад в энергию химической связи;
– в соответствии с принципом Паули химическая связь образуется лишь при взаимодействии электронов с антипараллельными спинами;
– характеристики химической связи (энергия, длина, полярность и др.) определяются типом перекрывания АО.
Условием образования химической связи является уменьшение потенциальной энергии системы взаимодействующих атомов.
Чем прочнее химическая связь, тем больше энергии нужно затратить для ее разрыва. Поэтому энергия разрыва связи служит мерой ее прочности.
Ковалентная связь может быть образована атомами одного и того же элемента и тогда она неполярная; например, такая ковалентная связь существует в молекулах одноэлементных газов H2, O2, N2, Cl2 и др.
Ковалентная связь может быть образована атомами разных элементов, сходных по химическому характеру, и тогда она полярная, например, Н2О, NF3 и др.
Особенностями ковалентной химической связи являются ее насыщаемость и пространственная направленность.
Насыщаемость ковалентной связи обусловлена ограничением числа валентных электронов, находящихся на внешних оболочках, участвующих в образовании ковалентной связи.
Способность атома присоединять или замещать определенное число других атомов с образованием химических связей называется валентностью.
В представлении метода валентных связейчисленное значение валентности данного атома соответствует числу ковалентных связей, которые он образует.Поскольку пребывание двух электронов с противоположными спинами в поле действия двух ядер энергетически выгоднее, чем нахождение каждого электрона в поле действия своего ядра, в образовании ковалентных связей принимают участие все имеющиеся одноэлектронные облака. Количественной мерой валентности в рамках метода валентных связей считают число неспаренных электронов у атома в основном или возбужденном состояниях. Это неспаренные электроны внешних оболочек у s - и p -элементов, внешних и предвнешних оболочек у d -элементов.
Например, электронное строение атома кислорода (1s22s22p4) выражается следующим распределением электронов по квантовым ячейкам Гунда:
| ↑↓ | ↑ | ↑ | ||
| ↑↓ | p | |||
| ↑↓ | ||||
| s |
В атоме имеется два неспаренных электрона, поэтому его валентность равна двум.
В ряде случаев число неспаренных электронов увеличивается в результате возбуждения атома вследствие небольшого энергетического воздействия, при котором двухэлектронные облака распадаются на одноэлектронные.
Возбуждение атомов требует затраты энергии, поэтому распаривание электронов возможно лишь в тех случаях, когда затрата энергии компенсируется энергией, выделяемой при образовании дополнительных связей.
Например, атом бериллия Ве имеет электронное строение 1s22s2, которое представлено следующим распределением электронов по квантовым ячейкам:
| ↑ | |||||||||||||
| ↓↑ | p | 
| ↑ | p | |||||||||
| Ве | ↓↑ | Be* | ↓↑ | ||||||||||
| s | s |
Однако атом бериллия может проявлять валентность, равную двум, за счет перехода одного из 2 s - электронов в свободную 2 р ячейку Гунда, что приводит к увеличению числа неспаренных электронов.
Следует иметь в виду, что такое распаривание электронов происходит в пределах данного энергетического уровня, так как для перехода электронов на новый энергетический уровень необходима значительно бóльшая энергия.
Аналогичным образом можно определить, что для атома фосфора валентности составляют 3 и 5, атома серы – 2, 4 и 6, а для атома хлора – 1, 3, 5, 7.
Направленность ковалентной связи. Перекрывание электронных облаков происходит по определенным направлениям, так как атомные орбитали пространственно ориентированы, что и обуславливает направленность ковалентной связи.
В зависимости от способа перекрывания и симметрии образующегося облака различаютs- (сигма) и  - (пи) связи.
- (пи) связи.
Связь, образованная электронами, орбитали которых дают наибольшее перекрывание по линии, соединяющей центры атомов, называется сигма-связью (рис. 2.1).
Связь, образованная электронами, орбитали которых дают наибольшее перекрывание по обе стороны от линии, соединяющей центры атомов, называется  - связью (рис. 2.1).
- связью (рис. 2.1).
В молекуле азота N≡N тройная связь между атомами азота реализуется за счет одной s-связи и двух  -связей.
-связей.

Рис. 2.1. Схема перекрывания орбиталей при образовании
s- и  -связей в молеуле N2
-связей в молеуле N2
Пространственная конфигурация молекул определяется числом атомов в молекуле и числом электронных пар связей за счет неподеленных электронов.
Поскольку электронные облака (кроме s- облака) направлены в пространстве, то химические связи, образуемые с их участием, пространственно направлены. Гантелевидные р -орбитали расположены в атоме взаимно перпендикулярно. Следовательно, угол между связями р -электронов атома, должен быть равен 90о. Таким образом, пространственное расположение s-связей определяет пространственную конфигурацию молекул.
Химическая связь в молекуле H2S образуется из атома серы и двух атомов водорода. Атом серы (S …3s23p4) имеет два неспаренных р -электрона, которые занимают орбитали, расположенные под углом 90° друг к другу. Атомы водорода имеют по 1 s -электрону. При сближении одного из атомов водорода с 1 s -электроном, спин которого направлен противоположно спину одного из неспаренных 2 р -электронов атома серы, образуется общее электронное облако, связывающее атомы серы и водорода (рис.2.2).
При этом угол между связями в молекуле H2S должен быть близок к углу между облаками р -электронов, т.е. к 90°. Аналогичную пространственную структуру имеют молекулы H2Se и H2Te.

Рис. 2. 2. Пространственная конфигурация молекулы H2S
Атом фосфора имеет три неспаренных р -электрона, орбитали которых расположены в трех взаимно перпендикулярных направлениях. Очевидно, в соответствии с требованиями метода валентных связей три s-связи в молекуле РН3 должны расположиться под углами одна к другой, близкими к 90° (рис. 2.3).
Аналогичное строение имеют молекулы AsH3 и SbH3, углы между связями также близки к 90°.

Рис. 2.3. Пространственная конфигурация молекулы РН3
Донорно-акцепторный механизм образования ковалентной связи. Ковалентная связь может образоваться не только за счет перекрывания одноэлектронных облаков, но и за счет двухэлектронного облака одного атома (донора) и свободной орбитали другого атома (акцептора). Например, в молекуле аммиака (NH3) азот имеет неподеленную пару электронов, а у катиона водорода (Н+) s-орбиталь свободна:

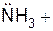 □
□ 
 .
.

Рис. 2.4. Образование катиона аммония
При достаточном сближении молекулы аммиака и катиона водорода возникает ковалентная связь с образованием катиона аммония [NH4]+ (рис. 2.4).
Следует подчеркнуть, что в образовавшемся катионе аммония все четыре связи N−H равноценны, не различимы и не зависят от первоначального происхождения.
 2.2. Гибридизация атомных орбиталей
2.2. Гибридизация атомных орбиталей
Изучение таких молекул, как ВеСI2, BCI3 , СН4 , показало, что все связи в них равноценны, несмотря на то, что в образовании их участвуют различные орбитали центрального атома. Слейтер и Полинг объяснили это явление тем, что орбитали различной симметрии, не сильно отличающиеся по энергиям, образуют гибридные орбитали.
Гибридизация − это процесс перераспределения электронных плотностей близких по энергии орбиталей, который приводит к их полной равноценности.
Число гибридных орбиталей равно числу орбиталей, участвующих в гибридизации. Гибридные орбитали более вытянуты в направлении образования химических связей и поэтому обуславливают лучшее перекрывание электронных облаков. По числу участвующих в гибридизации атомных орбиталей различают следующие, наиболее распространенные типы гибридизации: sp-,sр 2 - и sр 3.
Тип гибридизации определяется видом и количеством участвующих в гибридизации электронных орбиталей (табл. 2.1).
Таблица 2.1
Типы гибридизации и геометрия молекул
| Тип молекулы | Тип гибридизации | Число гибридных орбиталей атома А | Геометрия молекул | Валентные углы | Примеры |
| АВ2 | sp (s+p) | Линейная | 180° | BeF2, CO2, C2H2 | |
| АВ3 | sp2 (s+2p) | Плоская | 120° | BCl3, AlF3, C2H4 | |
| АВ4 | sp3 (s+3p) | Тетраэдри-ческая | 109,5° | H2O, NH3, SiH4, CCl4, CH4, |
Гибридизация одной s - и одной р - электронных орбиталей приводит к образованию двух гибридных sp - орбиталей (рис. 2.5).
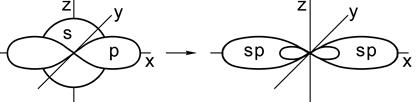
s -орбиталь и p -орбиталь → 2 гибридные sp -орбитали
Рис. 2.5. Образование sp-гибридных орбиталей
Относительно друг друга две гибридные sp -орбитали расположены под углом 180°, поэтому молекулы с таким видом гибридизации линейны, две связи в них расположены по прямой и противоположно направлены от ядра.
Гибридизация одной s - и двух р- электронных орбиталей приводит к образованию трех гибридных sр 2-орбиталей. Эти три гибридные орбитали расположены в одной плоскости и направлены в вершины равностороннего треугольника; углы между осями sр 2-гибридных орбиталей составляют 120°, например, в молекулах BH3, BCl3, AlF3.
Гибридизация одной s - и трех р -электронных орбиталей приводит к образованию четырех гибридных sр 3-орбиталей. В этом случае четыре гибридные орбитали имеют оси, лежащие в пространстве под углами 109,5°; они направлены к вершинам правильного тетраэдра.
Разные по составу молекулы СН4, NH3 и H2O имеют одинаковое пространственное расположение связей. Этот факт подтверждает гибридизацию орбиталей. Атомы углерода, азота и кислорода в указанных молекулах находятся в состоянии sp3 -гибридизации.
Молекула аммиака. В невозбужденном состоянии центральный атом азота в молекуле аммиака NH3 имеет 1 s2 2 s2 2 p3 -электронную конфигурацию.
Графическая схема распределения электронов по энергетическим ячейкам представлена схемой на рис. 2.6, согласно которой могут образоваться три взаимно перпендикулярные связи с тремя атомами водорода. Однако в действительности валентные углы в аммиаке равны 107° при тетраэдрическом их расположении. Азот в молекуле аммиака находится в sp3 - гибридном состоянии. При этом гибридизуются 2 s- орбиталь, заполненная парой электронов, и три 2 p -орбитали, имеющие по одному электрону. В результате получается четыре sp3- гибридных орбитали, из которых одна содержит неподеленную пару электронов. Остальные три гидридные орбитали перекрываются с орбиталями трех атомов водорода. Неподеленная пара электронов находится в одной из вершин тетраэдра, а атомы водорода расположены в вершинах основания тетраэдра, т.е. находятся в одной плоскости (рис. 2.6).

Рис. 2.6. Пространственная конфигурация молекулы NH3
Молекула воды. В молекуле воды H2O центральным атомом является атом кислорода, который в невозбужденном состоянии имеет следующую электронную конфигурацию: 1 s2 2 s2 2 p2 (рис. 2.7).
Кислород в молекуле воды также находится в состоянии sp3- гибридизации.
В отличие от молекулы аммиака, в молекуле воды имеются две гибридные орбитали с неподеленными парами электронов и две гибридные орбитали, имеющие по одному электрону. Валентный угол между связями равен 104,5°.

Рис. 2.7. Пространственная конфигурация молекулы Н2О
У рассмотренных молекул аммиака и воды углы между связями отклоняются от тетраэдрического 109°29′ и прямого 90°. Это обусловлено различием сил взаимного отталкивания орбиталей, заполненных только парой электронов, и орбиталей, перекрывающихся с атомами водорода. Орбитали с парой электронов, т.е. не имеющие области перекрывания, обладают бόльшим отталкивающим эффектов по сравнению с орбиталями, образующими связь.
В молекуле NH3 имеется одна sp3 -гибридная орбиталь, заполненная парой электронов, и она отталкивает в направлении от себя три остальные орбитали связи N−H, уменьшая угол до 107°. В молекуле H2O – две орбитали с парами электронов. Их влияние на орбитали связи еще сильнее, и угол H−O−H уменьшается до 104,5°.
Date: 2015-10-19; view: 1155; Нарушение авторских прав