
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Лабораторная работа №4
ОПРЕДЕЛЕНИЕ МАССЫ ЩАВЕЛЕВОЙ КИСЛОТЫ В КОНТРОЛЬНОМ РАСТВОРЕ H2C2O4·2H2O.
Метод титриметрического анализа: редоксиметрия, метод перманганатометрии.
Тип титрования: прямое титрование.
Цель работы: Познакомиться с методикой определения массы щавелевой кислоты в контрольном растворе
Задача:
1.Определить массу щавелевой кислоты H2C2O4·2H2O в контрольном растворе перманганатометрическим методом анализа по прилагающейся методике.
2. По результатам титрованиярассчитать массу (г) щавелевой кислоты H2C2O4·2H2O в объеме мерной колбы.
Чтобы определить массу щавелевой кислоты H2C2O4·2H2O в объеме мерной колбы (г /Vм.к.) необходимо оттитровать аликвотную часть контрольного раствора H2C2O4·2H2O стандартным раствором KMnO4, соблюдая условия титрования (температурный режим титрования и среду титрования).
Требования техники безопасности при выполнении работы:
1. Необходимо соблюдать свое рабочее место в чистоте и порядке.
2. При выполнении работы рационально использовать рабочее время
3. Необходимо соблюдать правила работы со стеклянной посудой.
4. Аликвоту раствора следует отбирать нагнетателем или грушей.
5. Необходимо соблюдать правила техники безопасности при работе с электрооборудованием.
6. Принимать пищу в лаборатории запрещается
7. По окончании работы необходимо убрать за собой рабочее место
1.Химическая сущность определения:
2KMnO4 + 5H2C2O4 + 8H2SO4 = 2MnSO4 + 10CO2 + K2SO4 + 8H2O
2| MnO4- + 8H+ + 5е- → Mn2+ + 4H2O
5| Н2C2O42- - 2e- → 2CO2 + 2H+
———————————————————————
2MnO4- + 5Н2C2O42- + 6H+ = 2Mn2+ + 10CO2 + 8H2O
Мэ (KMnO4) = М/5 = 31,61 г/моль
Мэ (H2C2O4·H2O) = M/2 = 63,03 г/моль
2.Методика определения массы H2C2O4·2H2O в контрольном растворе.
Химические реактивы:
1.вода дистиллированная
2.серная кислота, H2SO4, 2н раствор;
3.перманганат калия, KMnO4, стандартный раствор метода, установленной концентрацией;
4.щавелевая кислота, H2C2O4·2H2O,контрольный раствор;
Посуда и оборудование:
1.коническая колба, емкостью 250-300мл;
2.мерная колба, емкостью 100,00мл;
3.мерный цилиндр;
4.химическая воронка;
5.часовое стекло;
5.промывалка;
6.электрическая плитка.
Подготовить чистую мерную колбу с пробкой. Получить у лаборанта (или преподавателя) контрольный раствор H2C2O4·2H2O в мерной колбе, емкостью 100,00мл (или 200,00мл). Разбавить контрольный раствор в колбе до метки холодной дистиллированной водой, закрыть пробкой, тщательно перемешать.
Бюретку ополоснуть раствором KMnO4, затем налить в неё раствор KMnO4 до 0 (носик бюретки предварительно должен быть заполнен раствором KMnO4). Коническую колбу ополоснуть дистиллированной водой. Пипетку ополоснуть дистиллированной водой, а затем контрольным раствором H2C2O4·2H2O.
Пипеткой отобрать аликвоту (10,00мл) контрольного раствора H2C2O4·2H2O, перенести в коническую колбу, прилить 10мл 2н раствора H2SO4 и нагреть до 800С (не кипятить!). Горячий раствор в конической колбе оттитровать раствором KMnO4 до появления устойчивой слабо розовой окраски в точке эквивалентности.
Титрование повторить не менее 3-х раз. Вычислить средний объём KMnO4 пошедший на титрование контрольного раствора H2C2O4·2H2O. По результатам титрования выполнить расчеты.
3.Пример вычисления массы H2C2O4·2H2O в контрольном растворе по результатам титрования.
Задача. Контрольный раствор щавелевой кислоты, H2C2O4·2H2O, в мерной колбе ёмкостью 100,00 мл разбавили холодной дистиллированной водой до метки, закрыли пробкой и перемешали. Из мерной колбы отобрали аликвотную часть контрольного раствора и провели титрование. На титрование 10,00мл этого раствора расходуется 9,90мл раствора KMnO4 (средний объём) с Сн(KMnO4)=0,05103моль/л. Вычислить массу H2C2O4·2H2O в контрольном растворе.
| Дано: Сн(KMnO4)=0,05103моль/л Vк = 100,00 мл Vп = 10,00 мл V(KMnO4) = 9,90 мл Мэ(H2C2O4·2H2O)=М/2=63,03г/моль Мэ (KMnO4) = М/5 = 31,61 г/моль | 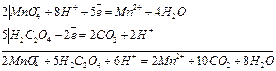 1.найдем по закону эквивалентных отношений концентрацию щавелевой кислоты, выраженной через нормальную концентрацию СН
1.найдем по закону эквивалентных отношений концентрацию щавелевой кислоты, выраженной через нормальную концентрацию СН
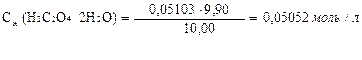 2.найдем массу щавелевой кислоты в контрольном растворе, т.е. в объеме мерной колбы
2.найдем массу щавелевой кислоты в контрольном растворе, т.е. в объеме мерной колбы
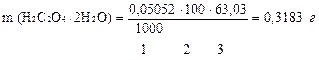 Вопросы к строчке:
1.Сколько моль-экв H2C2O4·2H2O содержится в 1,00мл раствора?
2.Сколько моль-экв H2C2O4·2H2O содержится в объеме мерной колбы, в 100,00мл раствора?
3.Сколько г H2C2O4·2H2O содержится в объеме мерной колбы 100,00мл раствора?
Вопросы к строчке:
1.Сколько моль-экв H2C2O4·2H2O содержится в 1,00мл раствора?
2.Сколько моль-экв H2C2O4·2H2O содержится в объеме мерной колбы, в 100,00мл раствора?
3.Сколько г H2C2O4·2H2O содержится в объеме мерной колбы 100,00мл раствора?
|
| m (H2C2O4·2H2O) -? |
4. Оформление лабораторной работы
4.1.Название лабораторной работы
4.2.Метод анализа:
4.3.Способ титрования
4.4.Цель работы:
4.5.Задачи работы:
4.6.Химическая сущность (закончить реакцию ОВР, уровнять методом полуреакций):
KMnO4 + H2C2O4 + H2SO4 =
4.7.Определить молярные массы эквивалентов (по полуреакции):
Мэ (KMnO4) =
Мэ H2C2O4·H2O =
4.8.Таблица результатов титрования
| № п/п | VH2C2O4· 2H2O | V(KMnO4) | Vср. (KMnO4) |
4.9. Вычисление массы щавелевой кислоты в контрольном растворе.
Подставляются свои данные, полученные по результатам предыдущих работ и по результатам титрования
| Дано: Vм.к.= VH2C2O4·2H2O = V KMnO4 = Сн KMnO4 = Мэ (KMnO4) = Мэ H2C2O4·2H2O = | |
| m (H2C2O4·2H2O) -? |
Вопросы для самоконтроля.
- Почему можно анализировать щавелевую кислоту методом перманганатометрии?
- Для чего раствор соли H2C2O4·2H2O подкисляют перед титрованием серной кислотой?
- Почему в методике определения объемы записаны следующим образом, поясните: «…отобрать аликвоту 10,00мл контрольного раствора H2C2O4·2H2O….. прилить 10мл 2н раствора H2SO4»
- Как фиксируется окончание реакции между раствором H2C2O4 ·2H2O и раствором KMnO4?
- Как правильно отобрать аликвоту контрольного раствора из мерной колбы.
- Как правильно заполнить носик бюретки.
- Зная массу щавелевой кислоты в контрольном растворе, в объеме мерной колбы, попробуйте вычислить титр этого раствора, нормальную и молярную концентрации.
Date: 2015-10-19; view: 2413; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |