
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Характеристики адсорбентов и их виды
|
|
В качестве адсорбентов применяются пористые твердые вещества с большой удельной поверхностью, обычно относимой к единице массы вещества. Адсорбенты имеют различные по диаметру капиллярные каналы— поры, которые условно могут быть разделены на макропоры (более 2×10-4 мм ), переходные поры (6×10-6-2×10-4 мм ), микропоры (2×10-6-6×10-6 мм ). Характер процесса адсорбции определяется размером пор.
Удельная поверхность макропор относительно очень мала, поэтому на их стенках адсорбируется ничтожное.количество вещества. Макропоры играют роль лишь транспортных каналов для адсорбируемых молекул.
На поверхности переходных пор, размеры которых обычно значительно превышают размеры адсорбируемых молекул, в процессе адсорбции образуются слои поглощенного вещества. Возможно образование слоев толщиной в одну молекулу (мономолекулярная адсорбция) и в несколько молекул (полимолекулярная адсорбция).
Размеры микропор приближаются к размерам адсорбируемых молекул и адсорбция в микропорах приводит к заполнению их объема. Вследствие этого предположение об образовании слоев поглощенного вещества на поверхности микропор не имеет физического смысла. Обычно микропоры пересекаются макро- и переходными порами, что сокращает путь, проходимый адсорбируемыми молекулами, и приводит к ускорению адсорбции.
В больших порах диаметром более 2·10-4 мм и малых порах, сравнимых с диаметром молекул поглощаемого вещества, явление капиллярной конденсации отсутствует.
Адсорбенты характеризуются своей поглотительной, или адсорбционной, способностью, определяемой концентрацией адсорбтива в единице массы или объема адсорбента.
Поглотительная способность адсорбента по отношению к данному веществу зависит от температуры и давления, при которых производится адсорбция, и от концентрации поглощаемого вещества. Максимально возможная при данных условиях поглотительная способность адсорбента условно называется его равновесной активностью.
В промышленности в качестве поглотителей применяют главным образом активные угли и минеральные адсорбенты (силикагель, цеолиты и др.) а также синтетические ионообменные смолы (иониты).
Активные угли. Высокопористые активные угли получают путем сухой перегонки различных углеродсодержащих веществ (дерева, костей и др.) и активирования полученных углей для повышения их пористости. Активирование осуществляют прокаливанием угля при температурах ≤ 900 °С, а также другими способами, например удалением из пор угля смол и некоторых других продуктов сухой перегонки путем их экстрагирования органическими растворителями, окислением кислородом воздуха и др. Для повышения активности углей в них часто перед обугливанием вводят активирующие добавки (растворы хлористого цинка, кислот, щелочей и др.).
Удельная поверхность активных углей колеблется от 600 до 1700 м2/г. Размер гранул некоторых стандартных марок активных углей для адсорбции газов и паров составляет 1-5 мм (уголь БАУ) и 1.5-2.7 мм (уголь СКТ). Насыпная плотность углей этих марок равна 260 и 420 г/л соответственно. Применение углей того или иного вида зависит от разновидности процесса адсорбции, в котором они используются (поглощение газов, рекуперация летучих растворителей и т.д.).
Активные угли лучше поглощают пары органических веществ, чем воды, однако с повышением содержания влаги в активных углях их способность поглощать пары органических веществ снижается. Они применяются обычно для рекуперации летучих растворителей. Недостатком активных углей является их горючесть.
Силикагели. Эти адсорбенты представляют собой продукты обезвоживания геля кремневой кислоты, получаемые путем обработки раствора силиката натрия (растворимого стекла) минеральными кислотами или кислыми растворами их солей. Удельная поверхность силикагелей изменяется от 400 до 770 м2/г. Размер гранул колеблется от 0,2 до 7 мм, насыпная плотность составляет 400-800 г/л.
Силикагели применяются главным образом для осушки газов. Поглотительная способность силикагелей по отношению к парам органических веществ сильно снижается в присутствии влаги. Достоинством силикагелей является их негорючесть и большая механическая прочность, чем у активных углей.
Цеолиты. Эти адсорбенты представляют собой природные или синтетические минералы, которые являются водными алюмосиликатами катионов элементов первой и второй групп периодической системы Д.И. Менделеева. В качестве промышленных адсорбентов применяются главным образом искусственные (синтетические) цеолиты. Относительно недавно были получены цеолиты, обладающие весьма однородной структурой пор, размеры которых соизмеримы с размерами адсорбируемых молекул. Эти цеолиты проявляют молекулярно-ситовое действие, которое заключается в их способности не поглощать молекулы, диаметр которых больше диаметра пор. Молекулярно-ситовыми свойствами обладают также некоторые природные цеолиты, например натролит. Молекулярно-ситовое действие цеолитов часто используют в промышленной практике для разделения некоторых веществ, например нормальных и изопарафиновых углеводородов.
Цеолиты отличаются высокой поглотительной способностью по отношению к воде и являются высокоэффективными адсорбентами для осушки и очистки газов и жидкостей, в частности для глубокой осушки газов, содержащих небольшие количества влаги. Размер гранул цеолитов составляет от 2 до 5 мм.
Иониты. Эти адсорбенты представляют собой как природные, так и синтетические неорганические и органические вещества. К природным ионитам относятся цеолиты, глинистые минералы, ископаемые угли и др. Синтетическими ионитами являются плавленые цеолиты и молекулярные сита (цеолиты с правильной кристаллической структурой), ионообменные смолы, активированные минералы и органические вещества и др.
Иониты практически нерастворимы в воде, а также в обычных растворителях и обладают подвижными ионами, способными обмениваться на эквивалентное количество ионов (с зарядом того же знака) из раствора электролита, с которым поглотитель контактирует.
Иониты, содержащие кислые активные группы и обменивающиеся с раствором электролита подвижными анионами, называются анионитами, а иониты, содержащие основные активные группы и обменивающиеся подвижными катионами, — катионитами. Существуют также амфотерные иониты, способные к катионному и анионному обмену одновременно.
Типичные реакции ионного обмена:
1. Реакция анионного обмена
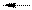
 2RC1 + Na2SO4 R2SО4 + 2NaCl
2RC1 + Na2SO4 R2SО4 + 2NaCl
где R — молекула ионита, связанная с подвижным ионом.
2. Реакция катионного обмена

 2NaR + СаСl2 CaR2 + 2NaCl
2NaR + СаСl2 CaR2 + 2NaCl
причем в обоих уравнениях выделены формулы веществ, составляющих твердую фазу.
Механизм ионного обмена обусловлен структурой и свойствами ионита. Так, например, иониты с кристаллической решеткой содержат в ее углах ионы, удерживаемые электростатическими силами; под действием этих сил и происходит в основном ионный обмен. Свойства многих ионитов связаны с их способностью к набуханию в водных растворах; набухание обычно сопровождается весьма значительным повышением давления.
Ионообменные смолы обладают большой обменной емкостью, избирательностью к отдельным ионам, химической стойкостью и механической прочностью. Поэтому сейчас они являются наиболее распространенными ионитами, практически вытеснившими в промышленных условиях иониты других типов.
Изменением состава активных групп при синтезе ионообменных смол можно получить иониты с весьма разнообразными свойствами.
Date: 2015-10-22; view: 7900; Нарушение авторских прав