
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Примеры решения задач. 10мл сыворотки крови взрослого человека содержат 0.015 г холестерина (C27H47O)
|
|
Пример 1.
10мл сыворотки крови взрослого человека содержат 0.015 г холестерина (C27H47O). Найдите процентную концентрацию по массе (массовую долю) и молярность, если принять плотность сыворотки ρ ≈1 г/мл.
Решение:
Процентную концентрацию C% можно найти следующим образом:
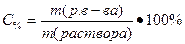 , где m(раствора) = V(раствора) · ρ =10 мл · 1г/мл = 10г, тогда C% =0.015·100/10=0.15%;
, где m(раствора) = V(раствора) · ρ =10 мл · 1г/мл = 10г, тогда C% =0.015·100/10=0.15%;
или воспользуемся определением процентной концентрации, которая показывает число грамм вещества в 100г раствора:
если 0.015г (холестерина) - в 10 г (сыворотки)
то X г (холестерина) - в 100 г (сыворотки),
и получаем такой же ответ: X=C% = 0.015 · 100 / 10 = 0.15 г = 0.15%
Молярная концентрация показывает число моль холестерина в 1 л раствора (сыворотки). Найдем сначала молярную(=молекулярную)массу: Mr(холестерина)= 27·Ar(C)+47·Ar(H)+1·Ar(O)=27·12+47·1+1·16=387;
М=387 г/моль, затем вычислим число моль вещества в данной пробе раствора (в 10мл): n = 0.015 / 387 = 0.0000388 (моль), наконец находим число моль вещества в 1л раствора: CM = 0.0000388 моль / 0.01 л = 0.00388 моль/л = 3.88 мМ.
Ответ: 0.15%; 3.88 мМ.
Пример 2.
Как приготовить 400мл 25% раствора магнезии (MgSO4) с плотностью ρ =1.2 г/мл из более концентрированного 5 М раствора?
Решение:
Найдем массу раствора, который мы собираемся приготовить:
m=V·ρ=400 ·1.2=480 (г)
В соответствии с определением процентной концентрации этот раствор должен содержать
25г (MgSO4) в 100г(раствора),
или X г (MgSO4) в 480г(раствора),
таким образом находим X=25·480 / 100 = 120 (г). Однако по условию задачи у нас нет кристаллического MgSO4, который мы могли бы взвесить для приготовления раствора: нужно разбавить более концентрированный раствор, который содержит 5 моль (MgSO4) в 1л, или это m (MgSO4)= n· M=5моль · 120 г/моль = 600 г.
Следовательно, найдем объем 5M раствора, который содержит 120 г MgSO4:
600г(MgSO4) – в 1000 мл
120г(MgSO4) – в X мл, тогда X= 200 мл.
Таким образом, мы отбираем 200мл 5M раствора MgSO4, помещаем в мерную колбу на 400мл, добавляем необходимое количество дистиллированной воды до метки (фактически раствор должен быть разбавлен в 2 раза).
Существует множество других способов решения этого задания. Например, можно использовать формулы или найти сначала число моль MgSO4, необходимое для приготовления раствора: n=120/120=1 моль,...и т.д.].
Ответ: 200мл 5М р-ра разбавить до 400мл.
Пример 3.
Раствор MgSO4, приготовленный в предыдущем задании, был проверен фармацевтом. Обнаружено, что точная концентрация раствора равна 2.5M. Найдите нормальность, титр, моляльность и мольную долю вещества, если плотность раствора равна 1.2 г / мл.
Каков курс лечения данным препаратом (сколько дней), если пациенту назначили инъекции по 5мл один раз в день и суммарная (кумулятивная) доза должна составить 125 ммоль?
Решение:
Для нахождения нормальной концентрации CN можно воспользоваться формулой CN ·Э = CM ·M, которая позволяет быстро перейти от молярности к нормальности (и наоборот). Для соли эквивалент равен: Э= 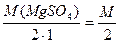 ,
,
поэтому CN ·M / 2 = CM ·M, после сокращения получаем CN = 2· CM = 2· 2.5 = 5 (N, н., моль/л)
Титр может быть найден следующим образом:
T=Э · CN / 1000 = 60 ·5 / 1000 = 0.3000 (г/мл)
Моляльная концентрация µ показывает число мольMgSO4 в 1 кг растворителя, поэтому найдем сначала массу 1л раствора, затем массу MgSO4, и наконец массу воды:
m(раствора) = ρ ·V = 1.2 ·1000 = 1200 (г),
m(MgSO4) = n · M = 2.5 · 120 = 300 (г),
m(H2O) = m(раствора) – m (MgSO4) = 1200-300 = 900 (г)
Если 2.5 моль (MgSO4) – в 900 г (воды),
то µ моль(MgSO4) – в 1000 г(воды), получаем µ=2.5·1000/900 = 2.78 (моль/кг)
Для нахождения мольной доли X найдем число моль воды:
n (H2O) = m / M = 900 / 18 = 50 (моль),
затем найдем отношение X(MgSO4) = 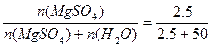 =0.048
=0.048
Если раствор магнезии используется в качестве лекарственного препарата, то с разовой дозой 5мл пациент получает следующее число моль MgSO4 :
2.5моль(MgSO4) – в 1000 мл(раствора)
X моль(MgSO4) - в 5 мл(раствора), тогда X=0.0125моль=12.5ммоль
ммоль(в день) · число дней = ммоль(суммарная доза)
12.5 · число дней = 125, => число дней = 10
Курс лечения 10 дней.
Ответ: 5н., 0.3000 г/мл, 2.78 моль/кг, 0.048; 10дней.
Date: 2015-09-24; view: 754; Нарушение авторских прав