
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Зміст ТЕМИ. Оцінка розмірів молекул. Приблизну оцінку розмірів молекул можна дістати з дослідів, проведених свого часу німецьким фізиком в
|
|
Оцінка розмірів молекул. Приблизну оцінку розмірів молекул можна дістати з дослідів, проведених свого часу німецьким фізиком В. Рентгеном і англійським фізиком Д. Релеєм. Якщо капнути на поверхню води крапельку олії, то вона розпливеться, утворивши тонку плівку завтовшки усього лише в одну молекулу. Товщину цього шару неважко визначити й тим самим оцінити розміри молекули олії. У даний час існує ряд методів, що дозволяють визначити розміри молекул і атомів. Наприклад, лінійні розміри молекули кисню становлять 3 10-10 м, води — близько 2,6 1010 м. Таким чином, характерною довжиною у світі молекул є розмір 10-10 м. Корисно не тільки запам'ятати цей параметр (10-10 м), але й образно уявити його собі. Це допоможе нам «увійти» у світ молекул. Легко перевірити, що якщо молекулу води збільшити до розмірів яблука, то саме яблуко стане розміром із земну кулю.
Кількість речовини. У минулому столітті італійський учений Авогадро виявив дивний факт: якщо два різні гази займають посудини однакового об'єму за однакових температур і тисків, то в кожній посудині міститься одне й те саме число молекул. Зауважимо, що маси газів при цьому можуть відрізнятися дуже сильно: наприклад, якщо в одній посудині водень, а в іншій — кисень, то маса кисню в 16 разів більша від маси водню.
Це означає, що деякі, причому досить важливі, властивості тіла визначаються числом молекул у цьому тілі: число молекул виявляється навіть більш важливим, ніж маса.
Фізична величина, що визначає число молекул у даному тілі, називається кількістю речовини й позначається буквою v.
Оскільки маси окремих молекул відрізняються одна від одної, то однакові кількості різних речовин мають різну масу. Наприклад, 1025 молекул водню й 1025 молекул кисню вважають однаковою кількістю речовини, хоча вони мають різні маси (33,45 і 531,45 г відповідно).
Таким чином, маса не є мірою кількості речовини. Одиницею кількості речовини є моль.
Один моль — це кількість речовини, що містить стільки ж молекул, скільки атомів Карбону міститься в 0,012 кг вуглецю.
Відносна молекулярна маса. Маси окремих молекул дуже малі. Наприклад, маса однієї молекули води дорівнює близько 2,7 10-26 кг. Молекули інших речовин мають маси такого ж порядку. Оскільки маси молекул дуже малі, зручно використовувати в обчисленнях не абсолютні значення мас, а відносні. За міжнародною угодою маси всіх атомів і молекул порівнюють із 1/12 маси атома Карбону. Головна причина такого вибору полягає в тому, що Карбон входить до складу великої кількості різних хімічних сполук.
Відносною молекулярною (або атомною) масою речовини МГ називається відношення маси молекули (або атома) та даної речовини до 1/12 маси атома Карбону:
Мr=  .
.
Наприклад, відносна атомна маса Карбону дорівнює 12,Гідрогену дорівнює-1. Відносна ж молекулярна маса водню дорівнює 2, оскільки молекула водню складається з двох атомів.
Отже, зручність вибору моля як одиниці вимірювання кількості речовини пов'язана з тим, що маса 1 моль речовини в грамах чисельно дорівнює його відносній молекулярній масі.
Молярна маса. Маса т тіла пропорційна кількості речовини 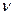 , що міститься в даному тілі. Тому відношення
, що міститься в даному тілі. Тому відношення  характеризує речовину, з якої складається це тіло: чим «важчі» молекули речовини, тим більше це відношення.
характеризує речовину, з якої складається це тіло: чим «важчі» молекули речовини, тим більше це відношення.
Відношення маси речовини т до кількості речовини 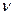 називається молярною масою й позначається М:
називається молярною масою й позначається М:
М =  .
.
Якщо прийняти в цій формулі 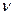 = 1, дістанемо, що молярна маса речовини чисельно дорівнює масі 1 моль цієї речовини. Наприклад, молярна маса водню дорівнює: М = 2
= 1, дістанемо, що молярна маса речовини чисельно дорівнює масі 1 моль цієї речовини. Наприклад, молярна маса водню дорівнює: М = 2  = 2 10 -3
= 2 10 -3 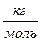 . Одиницею вимірювання молярної маси в СІ є
. Одиницею вимірювання молярної маси в СІ є 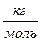 , оскільки маса вимірюється в кілограмах, а кількість речовини — в молях. Якщо молярна маса М і кількість речовини у відомі, можна знайти масу речовини: m =
, оскільки маса вимірюється в кілограмах, а кількість речовини — в молях. Якщо молярна маса М і кількість речовини у відомі, можна знайти масу речовини: m = 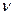 М.
М.
Стала Авогадро. Число N молекул, що містяться в тілі, також пропорційне кількості речовини 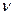 , що міститься в цьому тілі. Коефіцієнт пропорційності є сталою величиною; він називається сталою Авогадро й позначається NA:
, що міститься в цьому тілі. Коефіцієнт пропорційності є сталою величиною; він називається сталою Авогадро й позначається NA:
NA = 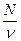 .
.
Звідси випливає, що стала Авогадро чисельно дорівнює числу молекул в 1 моль.
Стала Авогадро була виміряна багатьма способами. У результаті було
здобуте значення NA= 6,02 10 23 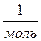 . У приблизних обчисленнях звичайно приймають NA= 6,02 1023 моль-1.
. У приблизних обчисленнях звичайно приймають NA= 6,02 1023 моль-1.
Якщо кількість речовини у даному тілі відома, легко знайти число молекул N у цьому тілі: N = 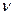 NA.
NA.
Знання сталої Авогадро дозволяє знайти масу однієї молекули. Дійсно, нехай дане тіло містить 1 моль речовини. Тоді маса тіла чисельно дорівнює М, а число молекул у ньому чисельно дорівнює NА. Позначаючи масу однієї молекули т0, дістаємо: т0 = 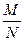 .
.
Можна сказати, що NA— це «місток» між макросвітом (світом оточуючих нас тіл) і мікросвітом (світом атомів і молекул).
Якщо дане тіло містить у моль речовини, то число молекул N у цьому тілі визначається виразом N = 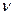 NA =
NA = 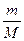 NA.
NA.
Відношення числа молекул N до об'єму V, який займають ці молекули, називається концентрацією молекул і позначається п:
п = 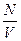 .
.
Одиниця вимірювання концентрації молекул — 1/м3.
Date: 2015-09-24; view: 514; Нарушение авторских прав