
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Качественные реакции анионов
Качественные реакции катионов и анионов
| Ион | Реактив | Уравнения реакций, наблюдения |
| NH4+ | NaOH, газовая камера | NH4Cl + NaOH ® NaCl + H2O + NH3 Запах, ф-ф бумага - краснеет |
| K+ | Na3[Co (NO2)6], меш. NH4+ | 2KCl + Na3[Co(NO2)6] ® K2Na[Co(NO2)6] ¯ + 2NaCl Желтый осадок¯ в слабокислой среде |
| Pb2+ | HCl | Pb(NO3)2 + 2HCl ® PbCl2¯ + 2HNO3 Белый осадок¯ растворимый в горячей воде |
| KI | PbCl2 + 2KI ® PbI2¯ + 2KCl Желтый осадок ¯ | |
| Hg22+ | HCl | Hg2(NO3)2 + 2HCl ® Hg2Cl2¯ + 2HNO3 Белый ¯ растворимый в NH4OH |
| NH3×H2O | Hg2Cl2¯ + 2 NH3×H2O ® [HgNH2]Cl¯ + Hg¯ + NH4Cl + 2H2O Черный ¯ - Спец. слив! | |
| Ag+ | HCl, NH3×H2O, HNO3 | AgNO3 + HCl ® AgCl¯ + HNO3; AgCl¯ + 2 NH3×H2O ® [Ag(NH3)2]Cl + 2H2O; |
| [Ag(NH3)2]Cl + 2HNO3 ® AgCl¯ + 2NH4NO3 Белый ¯ растворимый в NH3×H2O, образующийся снова в HNO3 Спец. слив! | ||
| Ba2+ | H2SO4 | BaCl2 + H2SO4 ® BaSO4¯ + 2HCl Белый¯ не растворимый в HNO3 |
| K2CrO4 или K2Cr2O7 | BaCl2 + K2CrO4 ® BaCrO4 ¯ + 2KCl (только Ba2+, не Ca2+) Желтый ¯ не растворимый в СH3COOH, растворимый в HNO3 | |
| Ca2+ | H2SO4 и C2H5OH | CaCl2 + H2SO4 + 2H2O ® CaSO4´2H2O¯ + 2HCl Кристаллы гипса под микроскопом |
| (NH4)2C2O4 | CaCl2 + (NH4)2C2O4 ® СaC2O4¯ +2NH4Cl Белый¯ не растворимый в СH3COOH, но растворимый в HNO3 | |
| Al3+ | Ализарин NH3×H2O | Соль Al на фильтр. бумагу; NH3; Ализарин; NH3; Сушить; Розовый лак. |
| Сr3+ | NaOH, H2O2, t | 2CrCl3 + 10NaOH + 3H2O2 ®2K2CrO4 + 6NaCl + 8H2O Желтый раствор |
| амиловый спирт, H2SO4 | Добавить изоамиловый спирт, H2SO4, наблюдать синее кольцо | |
| Fe2+ | K3[Fe(CN)6] | FeSO4 + K3[Fe(CN)6] ® KFe[Fe(CN)6]¯ + K2SO4 Тем.синий¯ турнбулевой сини |
| Fe3+ | K4[Fe(CN)6] | FeCl3 + K4[Fe(CN)6] ® KFe[Fe(CN)6]¯ + 3KCl Тем.синий¯ берлинской лазури |
| NH4CNS | FeCl3 + 3NH4CNS ® Fe(CNS)3 + 3NH4Cl Кроваво-красный раствор | |
| Mn2+ | NaBiO3(крист) в HNO3 | 2Mn(NO3)2 + 14HNO3 + 5NaBiO3 ® 2HMnO4 + 5Bi(NO3)3 + 5NaNO3 + 7H2O Розовый раствор |
| Cu2+ | NH3×H2O избыток | CuSO4 + 4NH3 ® [Cu(NH3)4]SO4 Синий раствор. Центрифугировать! |
| Co2+ | NH4CNS, амил. спирт | CoCl2 + 4NH4CNS ® (NH4)2[Co(SCN)4] +2NH4CNS Синее кольцо Если мешают ионы Fe3+, добавить кристаллический NH4F |
| Ni2+ | Р-в Чугаева, рН»9-10 | Розовый осадок |
Качественные реакции анионов
| Ион | Реактив | Уравнения реакций, наблюдения |
| SO42- | Ba(NO3)2 | Na2SO4 + Ba(NO3)2 ® BaSO4¯ + 2NaNO3 Белый¯ не растворимый в HNO3 |
| Cl- | AgNO3, NH4OH, | AgNO3 + HCl ® AgCl¯ + HNO3; AgCl¯ + 2NH4OH ® [Ag(NH3)2]Cl + 2H2O |
| HNO3 | [Ag(NH3)2]Cl + 2HNO3 ® AgCl¯ + 2NH4NO3 Белый¯ растворяется в NH4OH, образуется в HNO3 | |
| NO3- | Дифениламин в H2SO4 (конц) | Темно синее окрашивание на стенках пробирки |
| Окислительно-восстановительные реакции - это реакции, которые идут с изменением степеней окисления элементов. Степень окисления- это условный заряд атома в молекуле, где все полярные связи считаются ионными. Окисление - это процесс отдачи электронов. Восстановление - это процесс присоединения электронов. Окислитель - это атом, молекула или ион, который берет электроны. Восстановитель - это атом, молекула или ион, который даёт электроны. Активные металлыотносительно легко отдают электроны и являются восстановителями. Активные неметаллылегко присоединяют электроны и являются окислителями. Элемент в своей высшей степени окисления, когда уже отданы все валентные электроны, может быть только окислителем. Элемент в своей низшей степени окисления, заполнив все свои орбитали, может быть только восстановителем. В промежуточных степенях окисления элементможет иметь и окислительные и восстановительные свойства. Окислители, принимая электроны, переходят в восстановленную форму: F2 [ок.] + 2ē ® 2F- [вост.] Восстановители, отдавая электроны, переходят в окисленную форму: Na0 [вост.] - 1ē ® Na+ [ок.] Таким образом, как окислители, так и восстановители существуют в окисленной и восстановленной формах. При этом для окислителей более характерен переход из окисленной формы в восстановленную форму, а для восстановителей характерен переход из восстановленной в окисленную форму. | Равновесие между окисленной и восстановленной формами характеризуется с помощью уравнения Нернста для окислительно-восстановительного потенциала:
E = E о + 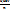 lg lg 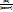 где Е о - стандартное значение окислительно-восстановительного (электродного) потенциала;
Е о = Е, если [восст] = [ок] = 1 моль/л; n - число переданных электронов, [восст] и [ок] - молярные концентрации соединения в восстановленной и окисленной формах соответственно.
Величины стандартных электродных потенциалов Е о приведены в таблицах и характеризуют окислительные и восстановительные свойства соединений:
чем положительнее величина Е о, тем сильнее окислительные свойства, и чем отрицательнее значение Е о, тем сильнее восстановительные свойства.
Например, для F2 + 2ē D 2F- Е о = 2,87 вольт (F2 - сильный окислитель), а для Na+ + 1ē D Na0 Е о = -2,71 вольт (Na - сильный восстановитель)
Процесс всегда записывается для реакций восстановления.
Метод электронно-ионного баланса
KMnO4 + H2SO4 + NaNO2 → MnSO4 + NaNO3 + K2SO4 + H2O
ок.MnO4- + 8H+ + 5ē → Mn2+ + 4H2O ´ 2
в.NO2- + H2O - 2ē → NO3- + 2H+ ´ 5
2KMnO4 + 3H2SO4 + 5NaNO2 → 2MnSO4 + 5NaNO3 + + 1K2SO4 + 5H2O
Na[Cr(OH)4] + NaOH + H2O2 → Na2CrO4 + H2O
в. Cr(OH)4- + 4OH- - 3ē → CrO42- + 4H2O ´ 2
ок. H2O2 + 2ē → 2OH- ´ 3
2Na[Cr(OH)4] + 2NaOH + 3H2O2 → Na2CrO4 + 4H2O
где Е о - стандартное значение окислительно-восстановительного (электродного) потенциала;
Е о = Е, если [восст] = [ок] = 1 моль/л; n - число переданных электронов, [восст] и [ок] - молярные концентрации соединения в восстановленной и окисленной формах соответственно.
Величины стандартных электродных потенциалов Е о приведены в таблицах и характеризуют окислительные и восстановительные свойства соединений:
чем положительнее величина Е о, тем сильнее окислительные свойства, и чем отрицательнее значение Е о, тем сильнее восстановительные свойства.
Например, для F2 + 2ē D 2F- Е о = 2,87 вольт (F2 - сильный окислитель), а для Na+ + 1ē D Na0 Е о = -2,71 вольт (Na - сильный восстановитель)
Процесс всегда записывается для реакций восстановления.
Метод электронно-ионного баланса
KMnO4 + H2SO4 + NaNO2 → MnSO4 + NaNO3 + K2SO4 + H2O
ок.MnO4- + 8H+ + 5ē → Mn2+ + 4H2O ´ 2
в.NO2- + H2O - 2ē → NO3- + 2H+ ´ 5
2KMnO4 + 3H2SO4 + 5NaNO2 → 2MnSO4 + 5NaNO3 + + 1K2SO4 + 5H2O
Na[Cr(OH)4] + NaOH + H2O2 → Na2CrO4 + H2O
в. Cr(OH)4- + 4OH- - 3ē → CrO42- + 4H2O ´ 2
ок. H2O2 + 2ē → 2OH- ´ 3
2Na[Cr(OH)4] + 2NaOH + 3H2O2 → Na2CrO4 + 4H2O
| Влияние среды на электродные потенциалы Окислительно-восстановительные свойства соединений зависят от характера среды. Например, окислительный потенциал KMnO4 уменьшается при переходе от кислой к нейтральной и щелочной среде: в кислой среде MnO4- + 5`e ® Mn+ Е0 = +1,51 в в нейтральной среде: MnO4- + 3e ® MnO2 Е0 =+0,60 в в щелочной среде: MnO4- + `e ® MnO4-2 Е0 = +0,56 в Соединения хрома (VI) являются сильными окислителями в кислой среде (Е0 = +1,33 в), восстанавливаясь в Cr+3, а соединения хрома (III) в щелочной среде проявляют восстановительную способность (Е0 = -0,13 в), окисляясь в соединения хрома (VI). Э.д.с. реакции Окислительно-восстановительная реакция представляет собой совокупность двух полуреакций, окисления и восстановления, и характеризуется электродвижущей силой (э.д.с.) D Е o: D Е o = Е oок - Е oвосст, где Е oок и Е oвосст - стандартные потенциалы окислителя и восстановителя для данной реакции. Связь э.д.с. реакции D Е с D G и К Э.д.с. реакции D Е связана с изменением энергии D G D G o = -n F D Е o или D Е o = -(1 /n F)D G o Э.д.с. реакции D Е связана с константой равновесия К: D Е = (0,059/n)lg K и К = 10nD Е /0,059 | Для самопроизвольного протекания реакции должно выполняться соотношения: D G <0 или К >>1, которым соответствует условие D Е о>0. Поэтому для определения возможности протекания данной окислительно-восстановительной реакции необходимо вычислить значение D Е о. Если D Е о>0, реакция идет. Если D Е о<0, реакция не идет Задача. Определить возможность протекания реакции: 2KMnO4 + 16HCl ® 2KCl + 2MnCl2 + 5Cl2 + 8H2O. Решение. Окислителем является перманганат-ион MnO4-, переходящий в Mn2+, а восстановителем - хлорид-ион, переходящий в газообразный хлор Cl2. Определяем по таблице их потенциалы: Е о(MnO4-/Mn2+) = 1,51 В и Е о(Cl2/2Cl-) = 1,36 В. Имеем D Е о = Е о ок - Е овосст = 1,51 - 1,36 = 0,15 в > 0. Реакция возможна, так как D Е о > 0. |
| Координационные соединения Координационные (комплексные) соединения - это соединения с донорно-акцепторной связью. Координационные соединения состоят из ионов внутренней и внешней сфер. Ионы внутренней сферы состоят из комплексообразователя и лигандов. Число лигандов во внутренней сфере комплекса называется координационным числом. Дентатность лиганда- это число связей, которыми данный лиганд соединен с комплексообразователем. Комплексы: K3[Fe(CN)6], [Ag(NH3)2]OH и др. Комплексообразователи: Ag+, Cu2+, Hg2+, Ni2+, Fe3+ и др. Лиганды: молекулы H2O, NH3 и анионы СN-, Cl-, OH- и др. Координационные числа: 4 или 6, реже 2, 3 и др. Состав координационных соединений Для K3[Fe(CN)6] имеем: • Ионы внешней сферы - 3К+ • Ион внутренней сферы - [Fe(CN)6]3- • Комплексообразователь - Fe3+ • Лиганды - 6CN-, их дентатность - 1 • Координационное число – 6 Для [Ag(NH3)2]OH имеем: • Ион внешней сферы - OH- • Ион внутренней сферы - [Ag(NH3)2]+ • Комплексообразователь - Ag+ • Лиганды - 2NH3, их дентатность - 1 • Координационное число - 2 | Номенклатура Назвать сначала анион (в именительном падеже), затем катион (в родительном падеже). Названия некоторых лигандов: NH3 - аммин, H2O - акво, CN- - циано, Cl- - хлоро, OH- - гидроксо. Названия координационных чисел: 2 - ди, 3 - три, 4 - тетра, 5 - пента, 6 - гекса. Указать степень окисления комплексообразователя. • [Ag(NH3)2]Cl - хлорид диамминсеребра(I) • [Cu(NH3)4]SO4 - сульфат тетрамминмеди(II) • K3[Fe(CN)6] - гексацианоферрат(III) калия • K2[PtCl4] - тетрахлороплатинат(II) калия • [PtCl4(NH3)2] -диамминтетрахлороплатина(IV) Химическая связь Согласно теории валентных связей лиганды связаны с центральным атомом донорно-акцепторной связью. Центральный атом является акцептором, а лиганды - донорами. При необходимости допускается использование внешних орбиталей соответствующей симметрии. Например, использование 4 d -АО для комплексов 3 d -металлов. Теория валентных связей предполагает гибридизацию орбиталей центрального атома. Расположение образующихся при этом гибридных орбиталей определяет геометрию комплексов. | Диамагнитный комплексный ион Fe(CN)64- Цианид ион СN- является донором ¯ СºN-. Ион железа Fe2+ - акцептор - имеет формулу 3 d 64 s 04 p 0. C учетом диамагнитности комплекса (все электроны спарены) и координационного числа (нужны 6 свободных орбиталей) имеем d 2 sp 3-гибридизацию. Комплекс Fe(CN)64- диамагнитный, низкоспиновый, внутриорбитальный, стабильный (не используются внешние электроны), октаэдрический (d 2 sp 3-гибридизация). Парамагнитный комплексный ион FeF63- Фторид ион - донор. Ион железа Fe3+ - акцептор - имеет формулу 3 d 54 s 04 p 0. C учетом парамагнитности комплекса (электроны распарены) и координационного числа (нужны 6 свободных орбиталей) имеем sp 3 d 2-гибридизацию: Комплекс парамагнитный, высокоспиновый, внешнеорбитальный, нестабильный (использованы внешние 4 d -орбитали), октаэдрический (sp 3 d 2-гибридизация). Диссоциация координационных соединений Координационные соединения в растворе полностью диссоциируют на ионы внутренней и внешней сфер. [Ag(NH3)2]NO3 ⇄ Ag(NH3)2+ + NO3- α = 1 Ионы внутренней сферы, то есть, комплексные ионы, диссоциируют на ионы металла и лиганды как слабые электролиты, по ступеням. | I ступень: Ag(NH3)2+ ⇄ Ag(NH3)+ + NH3 α << 1
II ступень: Ag(NH3)+ ⇄ Ag+ + NH3 α << 1
Суммарно: Ag(NH3)2+ ⇄ Ag+ + 2NH3 α << 1
Константы диссоциации комплексов – это константы нестойкости
Константы нестойкости
I ступень: Ag(NH3)2+ ⇄ Ag(NH3)+ + NH3
K 1 = 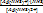 = 1,2´10-4
II ступень: Ag(NH3)+ ⇄ Ag+ + NH3
K 2 = = 1,2´10-4
II ступень: Ag(NH3)+ ⇄ Ag+ + NH3
K 2 = 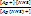 = 4,8´10-4
суммарно: Ag(NH3)2+ ⇄ Ag+ + 2NH3
K 1-2 = K 1× K 2 = = 4,8´10-4
суммарно: Ag(NH3)2+ ⇄ Ag+ + 2NH3
K 1-2 = K 1× K 2 =  5,8´10-8
К 1, К 2, K 1-2 называют константами нестойкости. Константы нестойкости приводятся в таблицах и характеризуют диссоциацию комплексов:
чем меньше константа нестойкости, тем меньше диссоциирует комплекс, тем он устойчивее.
Задача. Вычислите концентрацию ионов Fe3+ в 0,2М растворе K3[FeF6], в котором [F-] = 0,1M, если К 1-6 комплексного иона равна 8×10-17.
Решение. Уравнения диссоциации комплекса:
K3[FeF6] ⇄ 3K+ + FeF63- α = 1
FeF63- ⇄ Fe3+ + 6F- α << 1
K 1-6 = 5,8´10-8
К 1, К 2, K 1-2 называют константами нестойкости. Константы нестойкости приводятся в таблицах и характеризуют диссоциацию комплексов:
чем меньше константа нестойкости, тем меньше диссоциирует комплекс, тем он устойчивее.
Задача. Вычислите концентрацию ионов Fe3+ в 0,2М растворе K3[FeF6], в котором [F-] = 0,1M, если К 1-6 комплексного иона равна 8×10-17.
Решение. Уравнения диссоциации комплекса:
K3[FeF6] ⇄ 3K+ + FeF63- α = 1
FeF63- ⇄ Fe3+ + 6F- α << 1
K 1-6 =  = =  = 8×10-17
x = [Fe3+] = 1,6×10-11 M = 8×10-17
x = [Fe3+] = 1,6×10-11 M
|
| Основные классы неорганических соединений Оксиды - сложные вещества, состоящие из атомов кислорода в степени окисления -2 и атомов другого элемента Не являются оксидами Н2О2 – пероксид водорода OF2 – фторид кислорода КO2 – cупероксид калия Номенклатура оксидов Fe2O3 - оксид железа(III), Cl2O- оксид хлора(I). Получение оксидов Горение простых веществ: C + O2 = CO2 2Ca + O2 = 2CaO Горение (обжиг) сложных веществ: CH4 + 2O2 = CO2 + 2H2O 4FeS2 + 11O2 = 2Fe2O3 + 8SO2 Разложение сложных веществ: CaCO3 → CaO + CO2 2Fe(OH)3 → Fe2O3 + 3H2O Химические свойства основных оксидов Основные оксиды (Na2O, CaO, CuO) реагируют: с водой CaO + H2O = Ca(OH)2 (IА и IIА, кр. Be, Mg) CuO + H2O ¹ с кислотными оксидами СaO + CO2 = CaCO3 с кислотами CaO + 2HCl = CaCl2 + H2O | Химические свойства кислотных оксидов Кислотные оксиды (CO2, P2O5, CrO3) реагируют: c водой(кроме SiO2) SO2 + H2O = H2SO3 SiO2 + H2O ¹ с основными оксидами SO2 + CaO = CaSO3 с основаниями SO2 + 2NaOH = Na2SO3 + H2O Химические свойства амфотерных оксидов Амфотерные оксиды (ZnO, Al2O3, Cr2O3, BeO) не реагируют с водой ZnO + H2O ¹ реагируют с кислотами ZnO + 2HCl = ZnCl2 + H2O реагируют с щелочами при нагревании или сплавлении ZnO + 2NaOH → Na2ZnO2 + H2O в разбавленных растворах ZnO + 2NaOH + H2O = Na2[Zn(OH)4] Основания - сложные вещества, состоящие из атомов металла и гидроксильных групп; Основания - электролиты, образующие при диссоциации в качестве анионов только гидроксид ионы Номенклатура: NaOH - гидроксид натрия Fe(OH)3 - гидроксид железа(III) Классификация оснований растворимые (щелочи) NaOH, KOH. Нерастворимые Fe(OH)2, Mg(OH)2, Ni(OH)2, Сr(OH)2 амфотерные Zn(OH)2, Al(OH)3, Be(OH)2, Cr(OH)3 однокислотные NaOH, KOH двухкислотные Ba(OH)2, Zn(OH)2, трехкислотные Al(OH)3, Cr(OH)3, | Получение оснований Получение щелочей: 2Na + 2H2O = 2NaOH + H2 Na2O + 2H2O = 2NaOH NaH + H2O = NaOH + H2 Получение нерастворимых и амфотерных оснований: FeSO4 + 2NaOH = Fe(OH)2¯ + Na2SO4 AlCl3 + 3NaOH = Al(OH)3¯ + 3NaCl Свойства щелочей NaOH + HCl = NaCl + H2O 2NaOH + CO2 = Na2CO3 + H2O 2NaOH + Zn(OH)2 = Na2[Zn(OH)4] 2NaOH + Al2O3-(t)-> 2NaAlO2 + H2O 2NaOH + CuSO4 = Cu(OH)2¯ + Na2SO4 2NaOH + Zn + 2H2O = Na2[Zn(OH)4] + H2 2NaOH + 2Al + 6H2O = 2Na[Al(OH)4] + 3H2 2NaOH + Si + H2O = Na2SiO3 + 2H2 2NaOH + Cl2 = NaCl + NaClO + H2O (20 оС) 6NaOH + 3Cl2 = 5NaCl + NaClO3 + 3H2O (100 оС) Свойства нерастворимых и амфотерных оснований Свойства нерастворимых оснований: Fe(OH)2 + H2SO4 = FeSO4 + 2H2O Fe(OH)2 -(t)-> FeO + H2O Свойства амфотерных оснований: Al(OH)3 + 3HCl = AlCl3 + 3H2O Al(OH)3 + NaOH = Na[Al(OH)4]) 2Al(OH)3 -(t)-> Al2O3 + 3H2O | Кислоты - сложные вещества, состоящие из атомов водорода и кислотного остатка; кислоты - электролиты, образующие при диссоциации в качестве катионов только катионы водорода. Классификация кислот. одноосновные HCl двухосновные H2S трехосновные H3PO4 кислородосодержащие HNO3 бескислородные HСl Получение кислот CO2 + H2O = H2CO3 (кроме SiO2) Na2SiO3 + H2SO4 = Na2SO4 + H2SiO3¯ H2 + Cl2 = 2HCl Химические свойства кислот Fe + 2HCl = FeCl2 + H2 (Fe в ряду напр. до Н) Cu + HCl ¹ (Cu в ряду напр. после Н) 2HCl + CuO = CuCl2 + H2O 2HCl + Cu(OH)2 = CuCl2 + 2H2O 2HCl + ZnO = ZnCl2 + H2O 3HCl + Al(OH)3 = AlCl3 + 3H2O 2HCl + Na2CO3 = 2NaCl + H2O + CO2 HCl + AgNO3 = AgCl¯ + HNO3 HCl + NaNO3 ¹ Соли - сложные вещества, состоящие из атомов металла и кислотного остатка. Соли - электролиты, образующие при диссоциации катионы металла или аммония и анионы кислотного остатка. |
| Классификация солей средние MgCl2, Na3PO4 кислые Na2HPO4, Ca(H2PO4)2 основные MgOHCl, (Al(OH)2)2SO4 смешанные NaCl×NaF, CaBrCl двойные KMgF3, KAl(SO4)2 комплексные Na2[Zn(OH)4], K3[Al(OH)6] кристаллогидраты СuSO4´5H2O Получение солей Cu + 2H2SO4 конц. = CuSO4 + SO2 + 2H2O Cu + 2AgNO3 = Cu(NO3)2 + 2Ag CuO + H2SO4 = CuSO4 + H2O CuO + SO3 = CuSO4 Cu(OH)2 + H2SO4 = CuSO4 + 2H2O CuCO3 + H2SO4 = CuSO4 + H2O + CO2 CuCl2 + Ag2SO4 = CuSO4 + 2AgCl¯ Химические свойства солей CuSO4 + Fe = Cu + FeSO4 (Fe до Cu в ряду напряжений) Pb + ZnCl2 ¹ (Pb после Zn в ряду напряжений) CuSO4 + 2NaOH = Cu(OH)2¯ + Na2SO (образуется осадок) CuSO4 + H2S = CuS¯ + H2SO4 (образуется осадок) CuSO4 + BaCl2 = BaSO4¯ + CuCl2 (образуется осадок) | Разложение солей при нагревании Ca(HCO3)2 → CaCO3¯ + H2O + CO2 (при 100 oC) CaCO3 → CaO + CO2 (при 1000 oC) 2NaNO3 → 2NaNO2 + O2 (до Mg в ряду напряжений) 2Pb(NO3)2 → 2PbO + 4NO2 + O2 (от Mg до Cu в ряду напр.) 2AgNO3 → 2Ag + 2NO2 + O2 (после Cu в ряду напр.) NH4Cl → NH3 + HCl NH4NO3 → N2O + 2H2O (ОВР) NH4NO2 → N2 + 2H2O (ОВР) (NH4)2Cr2O7 → N2 + Cr2O3 + 4H2O (реакция “вулкан”) 4KClO3 → KCl + 3KClO4 (при 400 oC) 2KClO3 → 2KCl + 3O2 (в присутствии MnO2) 2KMnO4 → K2MnO4 + MnO2 + O2 Какой объем 2н раствора KOH можно приготовить из 140 мл 30% раствора KOH(r=1,3 г/мл)? Решение: с э 1(KOH) m 1/(M э(КОН)× V 1(KOH)) для раствора 1 w 2(KOH) = m 2/(r2(KOH)× V 2(KOH)) для раствора 2 Имеем m 1 = m 2 или с э× M э(КОН)× V 1 = w 2×r2× V 2 Отсюда V 1 = (w 2×r2× V 2)/(с э 1× M э(КОН)) = (0.3×1,3×140)/(2×56) = 0,4875 л | Химия элементов IA группы щелочные металлыLi, Na, K, Rb, Cs, Fr. Атомы этих элементов имеют электронную формулу n s 1. Они являются сильными восстановителями. Их активность растет от лития к цезию. Для них характерна степень окисления +1. В природе щелочные металлы находятся в виде хлоридов, сульфатов, карбонатов, силикатов и т.д. Получение и свойства щелочных металлов Получение 2NaCl → 2Na + Cl2 (электролиз расплава) горение в кислороде 4Li + O2 → 2Li2O (оксид лития) 2Na + O2 → Na2O2 (пероксид натрия) K + O2 → KO2 (супероксид калия) реакции с другими неметаллами 2Na+ Cl2 = NaCl 2Na + H2 = 2NaH 2K + S = K2S 6Li + N2 = 2Li3N реакции с водой и разбавленными кислотами 2Na + 2H2O = 2NaOH + H2 2Na + 2HCl = 2NaCl + H2 Получение и химические свойства оксидов щелочных металлов Оксиды щелочных металлов являются активными основными оксидами 4Li + O2 –(t)->2Li2O Na2O2 + 2Na –(t)->2Na2O Na2O + H2O = 2NaOH Na2O + CO2 = Na2CO3 Na2O(тв) + Al2O3(тв) –(t)->2NaAlO2 Na2O + 2HCl = 2NaCl + H2O | Получение и химические свойства гидроксидов щелочных металлов Гидроксиды щелочных металлов - это растворимые основания, щелочи NaOH ® Na+ + OH- (α»1) 2NaOH + CO2 = Na2CO3 + H2O 2NaOH + H2SO4 = Na2SO4 + 2H2O 2NaOH + Zn + 2H2O = Na2[Zn(OH)4] + H2 2NaOH + ZnO Na2ZnO2 + H2O NaOH + Al(OH)3 = Na[Al(OH)4] 3NaOH + FeCl3 = Fe(OH)3¯ + 3NaCl Получение и химические свойства соединений щелочных металлов Гидриды щелочных металлов – восстановители NaH + H2O = NaOH + H2 NaH + HCl = NaCl + H2 Пероксиды и супероксиды - окислители Na2O2 + 2H2O = 2NaOH + H2O2 Na2O2 + 2HCl = 2NaCl + H2O2 2Na2O2 + 2CO2 = 2Na2CO3 + O2 Na2O2 + 2KI + 2H2SO4 = Na2SO4 + I2 + K2SO4 + 2H2O 2KO2 + 2H2O = 2KOH + H2O2 + O2 Соли щелочных металлов Na2CO3 + H2O ⇄ NaHCO3 + NaOH 2Na+ + CO32- + H2O ⇄ HCO3- + OH- + 2Na+ CO32- + H2O ⇄ HCO3- + OH- |
Date: 2015-09-22; view: 329; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |