
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Электролиты и неэлектролиты
Электролитами называются вещества, распадающиеся на ионы в растворах и поэтому проводящие электрический ток. Распад электролитов на ионы при растворении их в воде называется электролитической диссоциацией. Под действием электрического тока ионы приобретают направленное движение: положительно заряженные ионы движутся к катоду и называются катионами ( ,
, 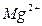 ,
, 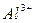 ), отрицательно заряженные - к аноду и называются анионами (
), отрицательно заряженные - к аноду и называются анионами (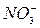 ,
,  ,
,  ).
).
Диссоциация – обратимый процесс, т.е. параллельно с распадом молекул на ионы (диссоциацией) протекает процесс соединения ионов (ассоциация). Поэтому в уравнениях электролитической диссоциации вместо знака равенства ставят знак обратимости.
Пример:
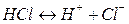

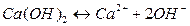
Вещества, не распадающиеся в растворах на ионы и не проводящие электрический ток, называются неэлектролитами (нефть, бензин, керосин, мазут, спирты, раствор сахара и т.д.).
По степени диссоциации различают сильные и слабые электролиты. Значения величин степени диссоциации некоторых электролитов приведены в табл. 3 приложения. Степень диссоциации 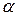 - это отношение числа распавшихся на ионы молекул n к общему числу растворенных молекул N:
- это отношение числа распавшихся на ионы молекул n к общему числу растворенных молекул N:
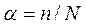
Степень диссоциации определяется опытным путем по величине электропроводности электролита и выражается в долях единицы или в процентах. Например, если 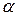 =20%, то это значит, что из 100 молекул данного электролита 20 молекул распалось на ионы. Если
=20%, то это значит, что из 100 молекул данного электролита 20 молекул распалось на ионы. Если 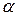 =0, то диссоциация отсутствует; если
=0, то диссоциация отсутствует; если 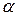 =1, то электролит полностью диссоциирует на ионы.
=1, то электролит полностью диссоциирует на ионы.
В зависимости от степени диссоциации все электролиты условно делятся на сильные (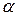 >0,3), средние (0,03<
>0,3), средние (0,03< 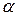 <0,3) и слабые (
<0,3) и слабые (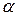 <0,03). Степень диссоциации зависит от природе электролита, концентрации раствора и температуры. Так, по закону разбавления Оствальда, с уменьшением концентрации электролита, т.е. при его разбавлении водой, степень диссоциации всегда увеличивается.
<0,03). Степень диссоциации зависит от природе электролита, концентрации раствора и температуры. Так, по закону разбавления Оствальда, с уменьшением концентрации электролита, т.е. при его разбавлении водой, степень диссоциации всегда увеличивается.
Date: 2015-09-24; view: 358; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |