
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Энергия активации. Энергетический профиль реакции
Реакции происходят в результате непосредственного столкновения молекул. Однако не все столкновения приводят к химическому взаимодействию. Образованию новых веществ способствуют только молекулы, обладающие достаточным запасом энергии. Такие молекулы называются активными молекулами.
Та минимальная энергия, достаточная для начала химической реакции называется энергией активации и выражается в ккал или кДж. Чем меньше энергия активации, тем быстрее идет реакция.
В реакциях, где энергия активации больше, чем 150 кДж при t=25°С скорость очень мала или практически эти реакции не протекают. В реакциях, где энергия активации меньше 60 кДж, скорость очень большая (взрыв).
Величина энергии активации Еа зависит от природы реагирующих элементов и служит характеристикой каждой реакции.
 |
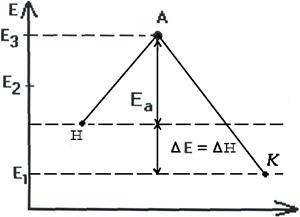
Энергетическая диаграмма хода реакции с образованием
активированного комплекса.
Чтобы реагирующие вещества А и В образовали продукты реакции С и Д они должны преодолеть энергетический барьер МL. На это затрачивается энергия активации Еа. При этом в ходе реакции из частиц реализующих веществ, образуется промежуточная неустойчивая группировка - активированный комплекс (рис.2.6).
Этот комплекс распадается с образованием конечных продуктов, причем выделяется такое количество энергии, которое позволяет конечным продуктам спуститься до уровня средней энергии конечных продуктов.
Т.о. изменение продуктов можно выразить в виде схем для эндотермической и экзотермической реакции (рис.2.7, 2.8).


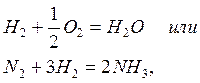 |
Обычно реакции между веществами с прочными ковалентными связями характеризуются большими значениями Еа и идут медленно. Это относится ко многим взаимодействиям, как
скорость которых при стандартных условиях равна 0.
 Малыми значениями Еа и очень большими скоростями характеризуются ионные взаимодействия в растворах
Малыми значениями Еа и очень большими скоростями характеризуются ионные взаимодействия в растворах
Date: 2015-09-24; view: 1637; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |