
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

На основе уравнения реакции количественного определения делают расчет К стех., f экв., Э
|
|
Общие методы анализа лекарственных средств. Расчет ориентировочного (теоретического) расхода титранта при количественном определении субстанций и растворов лекарственных средств».
Мотивация цели: Применение титриметрического метода анализа предполагает наличие у провизора – аналитика практических навыков по расчету ориентировочного расхода титранта. Основными ситуациями, при которых производятся данные расчеты, являются следующие:
1) составление методик количественного определения, ориентированных на оптимальный расход титранта (определение навески анализируемого вещества, концентрации титрованного раствора);
2) расчет количества титранта эквивалентного навеске определяемого вещества при обратном титровании для определения оптимального объема титранта, добавляемого в избытке;
3) расчет теоретического расхода титранта в методах, предполагающих определенную скорость добавления титранта в конце титрования (например, нитритометрия);
4) во всех случаях титрования знание теоретического расхода титранта обеспечивает большую точность титрования.
I.Расчет теоретического расхода титранта при количественном определении субстанций лекарственных средств.
На основе уравнения реакции количественного определения делают расчет К стех., f экв., Э.
2.Делают расчет титра – т.е. количества грамм определяемого вещества, вступающего в данной реакции количественного определения с 1 мл титранта данной концентрации, т.е по формуле
Т г/мл = 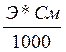
3.Дальнейший расчет ведут одним из следующих способов:
1) Расчет теоретического содержания определяемого вещества в объеме титруемого раствора (в колбе для титрования).
а) Если вся навеска помещается в колбу для титрования, расход титранта эквивалентен всей навеске.
Исходя из теоретического содержания 100% вещества в навеске, расчет делается по формуле:
V ор. = 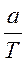 , где а – навеска определяемого вещества.
, где а – навеска определяемого вещества.
Например, количественное определение кальция глюконата.
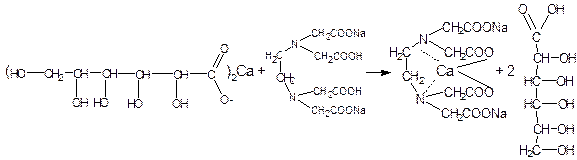 Методика комплексонометрического титрования кальция глюконата по ГФ Х: около 0,2 гр препарата (точная навеска) растворяют при подогревании в 10 мл воды. По охлаждении прибавляют 5 мл аммиачного буферного раствора, около 0,1 гр индикаторной смеси или 7 капель раствора кислотного хром темно- синего и титруют 0,05 н раствором трилона Б до сине-фиолетового окрашивания.
Методика комплексонометрического титрования кальция глюконата по ГФ Х: около 0,2 гр препарата (точная навеска) растворяют при подогревании в 10 мл воды. По охлаждении прибавляют 5 мл аммиачного буферного раствора, около 0,1 гр индикаторной смеси или 7 капель раствора кислотного хром темно- синего и титруют 0,05 н раствором трилона Б до сине-фиолетового окрашивания.
К стех. =  = 1; f экв. = 1; Э = М= 448,4
= 1; f экв. = 1; Э = М= 448,4
Т г/мл = 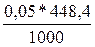 = 0,02242г/мл
= 0,02242г/мл
Vор. = 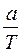 =
= 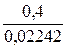 =17,84мл
=17,84мл
Ориентировочный (теоретический) расход титранта – 17,84мл
б) Если методика количественного определения предполагает предварительное разведение навески определяемого вещества в мерной колбе с последующим отбором пробы, которую помещают в колбу для титрования, то сначала делают расчет теоретического количества вещества в аликвоте:
а – V колбы
x гр – V пробы х = 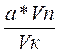
Соответственно теоретический расход титранта составляет:
Vор. = 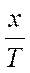
Например, количественное определение аскорбиновой кислоты.
Методика прямого йодатометрического титрования аскорбиновой кислоты по ГФ Х: около 0,5 гр препарата (точная навеска) растворяют в воде в мерной колбе ёмкостью 50 мл, доводят объем раствора водой до метки и перемешивают. К 10 мл приготовленного раствора прибавляют 0,5 мл 1% раствора йодида калия, 2 мл раствора крахмала и 1 мл 2% раствора соляной кислоты и титруют 0,1 н раствором йодата калия до появления стойкого слабо синего окрашивания.
 |
К стех. = 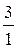 ; f экв. =
; f экв. = 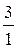 *
* 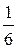 =
= 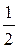 ; Э =
; Э = 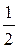 М=
М= 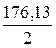 = 88,06
= 88,06
Т г/мл = 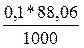 = 0,008806г/мл
= 0,008806г/мл
0,5 г – 50,0
х - 10,0 х = 0,1 г
Vор. = 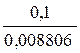 =11,36мл
=11,36мл
Ориентировочный (теоретический) расход титранта – 11,36мл
2) Второй способ расчета предполагает предварительное составление формулы расчета концентрации (в %) по методике количественного определения.
Затем, предположив Стеор. равной 100%, выводим Vтеор.
а) С%= 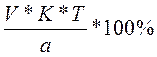
если С=100%, то 100% = 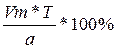 , отсюда Vт=
, отсюда Vт= 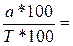
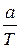
К – поправочный коэффициент в расчетах игнорируем, если равен 1
б) С%= 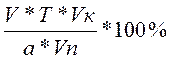
если С теор.= 100%, то 100% = 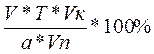 , отсюда
, отсюда
Vтеор.= 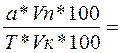
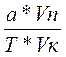
Если титрование обратное, то рассчитывают по этим формулам разность объемов, т.е тот объем титранта который израсходован на реакцию с определяемым веществом.
Например, количественное определение хлоралгидрата.
(Самостоятельно)
| <== предыдущая | | | следующая ==> |
| Расчетные формулы | | | Е.Омельченко Краткий обзор отечественных и зарубежных теорий молодёжи |
Date: 2015-09-27; view: 4518; Нарушение авторских прав