
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Вопрос ,,Растворение как физико-химический процесс. Растворение веществ , состоящих из ионных кристаллов и полярных молекул
|
|
Растворы - однородная многокомпонентная система, состоящая из растворителя, растворённых веществ и продуктов их взаимодействия.
По агрегатному состоянию растворы могут быть жидкими (морская вода), газообразными (воздух) или твёрдыми (многие сплавы металлов).
Растворение как физико-химический процесс. Растворы образуются при взаимодействии растворителя и растворённого вещества. Процесс взаимодействия растворителя и растворённого вещества называется сольватацией (если растворителем является вода - гидратацией). Растворение протекает с образованием различных по форме и прочности продуктов - гидратов. При этом участвуют силы как физической, так и химической природы. Процесс растворения вследствие такого рода взаимодействий компонентов сопровождается различными тепловыми явлениями.
Энергетической характеристикой растворения является теплота образования раствора, рассматриваемая как алгебраическая сумма тепловых эффектов всех эндо- и экзотермических стадий процесса. Наиболее значительными среди них являются:
– поглощающие тепло процессы - разрушение кристаллической решётки, разрывы химических связей в молекулах;
– выделяющие тепло процессы - образование продуктов взаимодействия растворённого вещества с растворителем (гидраты) и др.
Если энергия разрушения кристаллической решетки меньше энергии гидратации растворённого вещества, то растворение идёт с выделением теплоты (наблюдается разогревание). Так, растворение NaOH – экзотермический процесс: на разрушение кристаллической решётки тратится 884 кДж/моль, а при образовании гидратированных ионов Na+ и OH- выделяется соответственно 422 и 510 кДж/моль.
Если энергия кристаллической решётки больше энергии гидратации, то растворение протекает с поглощением теплоты (при приготовлении водного раствора NH4NO3 наблюдается понижение температуры). Растворение веществ сопровождается тепловым эффектом: выделением или поглощением теплоты - в зависимости от природы вещества. При растворении в воде, например, гидроксида калия, серной кислоты наблюдается сильное разогревание раствора, т.е. выделение теплоты, а при растворении нитрата аммония - сильное охлаждение раствора, т.е. поглощение теплоты. В первом случае осуществляется экзотермический процесс (∆H < 0), во втором - эндотермический (∆H > 0). Теплота растворения ∆H - это количество теплоты, выделяющееся или поглощающееся при растворении 1 моль вещества. Так, для гидроксида калия ∆H ° = -55,65 кДж/моль, а для нитрата аммония ∆H ° = +26,48 кДж/моль.
Растворы образуются при взаимодействии растворителя и растворённого вещества. Процесс взаимодействия растворителя и растворённого вещества называется сольватацией (если растворителем является вода - гидратацией).Особенно склонны к гидратации (соединению с водой) ионы. Ионы присоединяют полярные молекулы воды, в результате образуются гидратированные ионы; поэтому, например, в растворе ион меди (II) голубой, в безводном сульфате меди он бесцветный. Многие из таких соединений непрочны и легко разлагаются при выделении их в свободном виде, однако в ряде случаев образуются прочные соединения, которые можно легко выделить из раствора кристаллизацией. При этом выпадают кристаллы, содержащие молекулы воды.
Растворение кристалла в жидкости протекает след образом. Когда вносят кристалл в жидкость, в которой он может растворяться, от поверхности его отрываются отдельные молекулы.Последние благодаря диффузии равномерно распределяются по всему объему растворителя. Отделение молекул от поверхности тверд тела вызывается, с одной стороны их собственным колебательным движением, а с другой стороны -притяжением со стороны молекул растворителя. Этот процесс должен был бы продолжаться до полного растворения любого количества кристаллов, если бы одновременно не происходил обратный процесс -кристаллизация. Перешедшие в раствор молекулы, ударяясь о поверхность еще не растворившегося вещества, снова притягиваются к нему и входят в состав его кристаллов. Понятно, что выделение молекул из раствора будет идти тем быстрее, чем выше их концентрация в растворе. А так как последняя по мере растворения вещества увеличивается, то, наконец, наступает такой момент, когда скорость растворения становится равной скорости кристаллизации. Тогда устанавливается динамическое равновесие, при котором в единицу времени столько же молекул растворяется, сколько и выделяется из раствора. Раствор, находящийся в равновесии с растворяющимся веществом, называется насыщенным раствором. Ненасыщенный раствор - раствор, содержащий меньше вещества, чем в насыщенном. Перенасыщенный раствор - раствор, содержащий больше вещества, чем в насыщенном.
При растворении ионных соединений в воде или других полярных растворителях ионы "вытягиваются" из кристаллической решетки силами притяжения молекул растворителя:
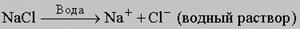
при этом они сольватируются, т.е. более или менее прочно связываются с молекулами растворителя (в уравнении это не отражено), так что, например, ионы натрия находятся в виде Na+(H2O)x. Хорошо растворимый в воде газ хлороводород тоже диссоциирует на ионы водорода и хлорид- ионы:
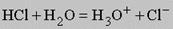
Молекулы воды притягивают ионы водорода, и образуются ионы гидроксония Н3О+. Менее полярные соединения (спирты или сахара и т.п.) в воде почти не диссоциируют. Иногда вещество начинает растворяться в результате химической реакции, которая изменяет его свойства. Так, мрамор (или известняк СаСО3) в чистой воде практически нерастворим, но растворяется в воде подкисленной:

Молекулы некоторых твердых веществ настолько прочно связаны друг с другом, что эти вещества не растворяются ни в одном растворителе, за исключением тех, с которыми взаимодействуют химически. В качестве примеров можно привести алмаз, графит, стекло и песок.
Date: 2015-09-26; view: 1742; Нарушение авторских прав